
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
A、①②③④⑤ B、②③④⑤ C、①③④ D、①②③④
科目:高中化学 来源: 题型:
空气中的自由电子附着在分子或原子上形成的空气负离子(也叫阴离子)被称为“空气维生素”。O 就是一种空气负离子,其摩尔质量为( )
就是一种空气负离子,其摩尔质量为( )
A.32 g B.33 g
C.32 g·mol-1 D.33 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2===NO +NO↑+H2O
+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应:2HCO +Ca2++2OH-===CaCO3↓+CO
+Ca2++2OH-===CaCO3↓+CO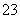 +2H2O
+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应:2MnO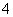 +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO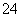 +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子组中,在相应的环境中能大量共存的是
| 选项 | 环境要求 | 离子 |
| A | 溶液中c(K+)<c(Cl-) | K+、AlO |
| B | 溶液pH﹥7 | Na+、S2-、K+、ClO- |
| C | 水电离产生的c(H+)=10-12 mol/L的溶液 | ClO-、CO |
| D | 向溶液中逐滴滴加烧碱溶液先有沉淀产生,后沉淀消失 | Na+、Al3+、Cl-、SO |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作和说法正确的是
A、用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿
B、润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次
C、用瓷坩埚加热熔化碳酸钠固体
D、Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性
查看答案和解析>>
科目:高中化学 来源: 题型:
CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
① 此温度下,该反应的平衡常数K=________(注明单位)。
② 保持温度不变,改变CH4和CO2的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内气体平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗2a mol H2
d.混合气中n(CH4)∶n(CO2)∶n(CO)∶n(H2) =1∶1∶4∶4
③ 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=_______________ kJ·mol-1
2CO(g)+2H2(g)的△H=_______________ kJ·mol-1
 (2)用Cu2Al2O4做催化剂,一定条件下,发生反应:
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:
CO2+CH4 CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________________________ __________。
CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________________________ __________。
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是_________。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
 c. 可在ⅠA、ⅡA族元素的氧化物中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式___________ ____________________________________。
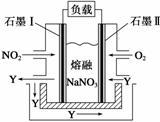
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,有关电极反应可表示为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用碳酸钠晶体(Na2CO3·10H2O)来配制0.1 mol·L-1的Na2CO3溶液500 mL。
(1)应称取碳酸钠晶体________g。
(2)若称量时砝码与晶体位置左右颠倒,则平衡后实际称得的样品质量为________g(5 g以下使用游码)。
(3)配制溶液时需要用到的仪器有____________________________________。
(4)假如其他操作均准确无误,下列情况会引起所配溶液浓度偏高的是________。
A.容量瓶洗净后内壁上带有少量蒸馏水
B.定容时,俯视观察刻度线
C.移液时,用于溶解碳酸钠晶体的烧杯没有冲洗
D.定容后,将容量瓶振荡摇匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.目前加碘食盐中主要添加的是KIO3
B.日常生活中无水乙醇常用于杀菌消毒
C.绿色食品是不含任何化学物质的食品
D.在空气质量日报中CO2含量属于空气污染指数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com