
有机物X的结构如下,下列说法正确的是
A. X能发生氧化、取代、酯化、加聚、缩聚反应
B. X与FeCl3溶液不能发生显色反应
C. 1mol X与足量NaOH溶液反应,最多消耗2mol NaOH
D. X的分子式为C23H26 N2O7
【知识点】有机物的结构与性质、有机反应类型
【答案解析】A 解析:A、根据结构,含有羟基、氨基,能氧化、取代、酯化;含碳碳双键,能加聚;含羟基和羧基,能缩聚,故A正确;B、右端是酚羟基,FeCl3溶液发生显色反应,故B错误; C、1mol X中分别含有含有1mol羧基、酚羟基、肽键、酯基,酯基水解产物又有酚羟基,所以1mol X与足量NaOH溶液反应,最多消耗5mol NaOH,故C错误;
D、X的分子式为C23H23N2O7;故D错误。
故答案选A
【思路点拨】本题考查常见有机物的化学反应,在解此类题时,首先需要知道物质发生反应的条件,熟记各官能团的性质是解题的关键,难度不大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列有关实验的叙述中,正确的是( )
|
| A. | 容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液 |
|
| B. | 用分液的方法分离水和酒精的混合物 |
|
| C. | 配制1L0.1mol/L的NaCl溶液时可用托盘天平称量5.85gNaCl固体 |
|
| D. | 用滴管滴加液体时,为防止液滴飞溅,滴管紧贴试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃下,某反应达到平衡,平衡常数K=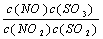 。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
A.该反应的焓变为正值 B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度
C.升高温度,逆反应速率减小 D.该反应化学方程式为:NO+SO3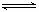 NO2+SO2
NO2+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A.微粒X2-与Y2+核外电子排布相同,离子半径:X2-> Y2+
B.人们可在周期表的过渡元素中寻找催化剂、耐腐蚀和耐高温的合金材料
C.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F
D.Be元素与Al元素同处在周期表的金属与非金属的交界处,可推出:
Be(OH)2+ 2OH-=BeO22-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
已知:①
②莫尔盐在乙醇溶剂中难溶。
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是 。
(2)步骤3中包含的实验操作名称 。
(3)产品莫尔盐最后用 洗涤(填字母编号)。
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500 mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000 mol·L-1的酸性KMnO4溶液分三次进行滴定。
(乙)方案二:取20.00 mL硫酸亚铁铵溶液进行如下实验。

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为
,验证推测的方为: 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00 mL硫酸亚铁铵溶液进行该实验。


(2)①装置 (填“甲”或“乙”)较为合理,判断理由是 。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准 KMnO4溶液V2mL
B. 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为cg
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测定干燥管I增重dg
查看答案和解析>>
科目:高中化学 来源: 题型:
使用化学手段可以消除某些环境污染。下列主要依靠化学手段消除环境污染的是 ( )
A.在燃煤中添加生石灰 B.将某些废旧塑料融化后再成型
C.把放射性核废料深埋于地下岩层 C.用多孔吸附剂清除水面油污
查看答案和解析>>
科目:高中化学 来源: 题型:
天然气化工是指通过甲烷的化学反应来生产一系列化工产品的工艺过程。以天然气为原料经下列反应路线可得工程塑料PBT。
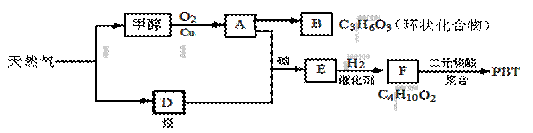
(1)B分子结构中只有一种氢、一种氧、一种碳,则B的结构简式是 ;B的同分异构体中与葡萄糖具有类似结构的是 。(写结构简式)
(2)F的结构简式是 ;PBT属于 类有机高分子化合物。
(3)由A、D生成E的反应方程式为 ,其反应类型为 。
(4)E的同分异构体G不能发生银镜反应,能使溴水褪色,能水解且产物的碳原子数不等,则G在NaOH溶液中发生水解反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,pH (填“越大”、“越小”或“不变”)。
②如将AlT = 2.520 mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图20—1。当T>80℃时,AlT显著下降的原因是 。
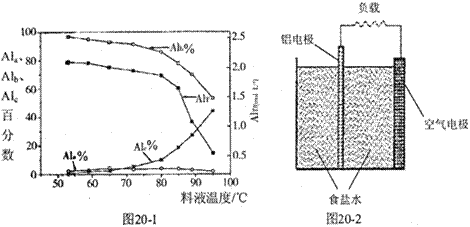
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1 = a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g) △H2 = b kJ·mol-1
则反应Al2O3(s)+ 3C(s) = 2Al(l)+ +3CO(g) △H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图20-2所示,写出该电池正极的电极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com