
下列关于化学用语的表示正确的是
A.过氧化钠电子式: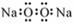
B.质子数35、中子数45的溴原子: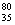 Br
Br
C.硫离子结构示意图: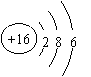
D.HCN的结构式:H—N=C
科目:高中化学 来源: 题型:
丰富多彩的材料使我们的生活更美好。
⑴生产硅酸盐水泥和普通玻璃都用到的主要原料是 (填名称)。
⑵生活中有大量的铝制品。家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
⑶鉴别真假羊毛衫的方法是先取样,再_____ _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固 体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
A.Mg和Al的总质量为8g
B.硫酸的物质的量浓度为5 mol/L
C.生成的H2在标准状况下的体积为11.2L
D.NaOH溶液的物质的量浓度为5mol/L
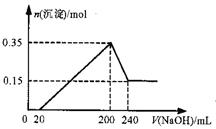
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应3A(g)+B(g) C(s)+4D(g) ΔH<0,
C(s)+4D(g) ΔH<0,
右图中a、b表示一定条件下,D的体积分数随时间t的变化
情况。若要使曲线b变为曲线a,可采取的措施是( )
①增大B的浓度 ②升高反应温度
③缩小反应容器的体积(加压) ④加入催化剂
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各
国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇, 一定条件下发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
 (1)写出该反应的平衡常数表达式:K= ;已知:K(300℃)>K(350℃),则该反应是_______反应。(填“吸热”或“放热”)
(1)写出该反应的平衡常数表达式:K= ;已知:K(300℃)>K(350℃),则该反应是_______反应。(填“吸热”或“放热”)
(2)下列情况不能说明该反应一定达到平衡的是
A.混合气体的平均平均相对分子质量不变 B.混合气体的压强不变
C.单位时间内生成3mol H—H键,同时生成2 mol C=O键
D.混合气体中 c (H2) : c (CH3OH) = 3:1
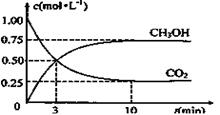
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1
(4)下列措施中能使(3)题中n(CH3OH)/n(CO2)增大的有 。(填字母)
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(5)若在另一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,并使初始体积与(3)题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数 ________ (3)题中的CO2的体积百分数。(填“>”或“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学键的叙述,正确的是
A.离子化合物中一定含有离子键 B.单质分子中均存在化学键
C.由不同种非金属元素的原子形成的共价化合物一定只含极性键
D.含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
B.l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA
C.1 mol Na2O2固体中含离子总数为4NA
D.常温下,1 mol Fe与过量浓HNO3反应,转移电子的数目为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
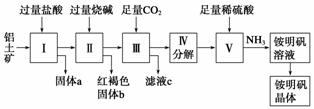
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
请回答下列问题:
(1)固体a的化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________________________________________________________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
 (3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84 g·cm-3)________ L(保留一位小数)。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84 g·cm-3)________ L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L密闭容器中,在一定条件下发生A+3B 2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则ν(C)为
2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则ν(C)为
A.0.04mol/(L.s) B.0.08mol/(L.s) C.0.4mol/(L.s) D.0.8mol/(L.s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com