
【题目】关于下列各装置图的叙述不正确的是
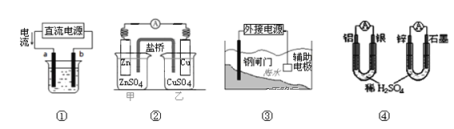
A. 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B. 图②装置盐桥中KCl的Cl﹣移向甲烧杯
C. 图③装置中钢闸门应与外接电源的正极相连获得保护
D. 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
【答案】C
【解析】
A.电解精炼铜,粗铜做阳极,精铜做阴极,用图①装置精炼铜,由图可知电流由电源正极流向电解池a极,则a极为阳极,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液,故A正确;
B.盐桥是起到平衡电解质液中电荷、保持电荷守恒作用的,甲烧杯中锌离子增多,氯离子移向甲烧杯;即图②装置盐桥中KCl的Cl-移向甲烧杯,故B正确;
C.图③装置中钢闸门应与外接电源的负极相连获得保护,钢闸门作阴极被保护,故C错误;
D.两个原电池中分别是铝和稀硫酸反应,锌和稀硫酸反应,分别是Al、Zn作负极材料,1molAl失去3mol电子,1molZn失去2mol电子,电子转移相同时消耗的铝和锌物质的量不同;即图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同,故D正确。答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______________。
(2)该反应为_______________反应(填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为_______________℃。
(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的浓度分别为2mol·L-1、2mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡向__________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(气)![]() bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。

如果此方案正确,那么:
(1)操作④为________,操作①、④、⑤都用到的玻璃仪器有____________。
(2)操作②为什么不用硝酸钡溶液,其理由是______________。
(3)进行操作②后,如何判断SO42-已除尽,方法是____________________。
(4)操作③的目的是_____________________________________。
(5)操作⑤的目的是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为1 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 常温常压下,1 NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5 mol NH3②标准状况下22.4 L He ③4 ℃ 9 mL水 ④19.6 g H3PO4
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol的Fe含___________个铁原子(用6.02×1023表示阿伏加德罗常数),质量是_______g;
(2)2mol CO2中含______ mol碳原子__________个氧原子(以NA为阿伏加德罗常数的值),________个质子(以NA为阿伏加德罗常数的值),标准状况下的体积为___________L,质量是______________g。
(3)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g,
①CO的质量为________
②混合气体的平均摩尔质量为________
③CO2的体积为________
④混合气体的密度为_____(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是______。
(2)本实验需量取浓硫酸的体积为___mL。
(3)在容量瓶使用方法中,下列操作不正确的是_____(填序号)。
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将确量取的18.4mol·L1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况使所配制的稀硫酸浓度偏大是_____ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )

A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. a点水电离的n(H+)大于c点水电离的n(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com