
铁、铝、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题:
(1)铝的原子结构示意图为________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是________________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:________________________。
(3)如图K82所示的装置中,铁作________极,铜电极的电极反应式为________________。
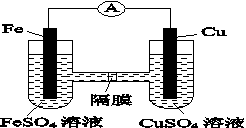
图K82
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热,并通入氯气,可得到氯化铝,同时生成CO。写出该反应的化学方程式:________________________________________。该反应中的氧化剂是________。
(6)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为____________(填化学式)。
科目:高中化学 来源: 题型:
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N(部分产物及反应条件已略去)。
(1)生成M、N的反应类型分别是 、 ; D的结构简式是 。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。C的结构简式是 。
(3)由苯酚生成A的化学方程式是 。
B与C反应的化学方程式是 。
(4)以苯酚为基础原料也可以合成芳香族化合物F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31.6%,F完全燃烧只生成CO2和H2O。则F的分子式是 。
已知:①芳香族化合物F能发生银镜反应,且还能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“-O-O- ”的连接方式。F的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体的成分中含有NH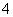 、Fe2+、SO
、Fe2+、SO
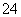 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成 ,则可证明晶体的成分中含有结晶水
,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液 ,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH
,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH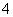
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO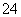

D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与酸性KMnO4溶液反应的离子方程式为_______________________________。
(3)滴定时,根据现象_______________________________________,即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列类比关系正确的是
A.AlCl3与过量NaOH溶液反应生成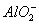 ,则与过量NH3·H2O也生成
,则与过量NH3·H2O也生成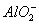
B.Na 2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
向NaBr、NaI、Na2CO3的混合溶液中通入足量氯气后,将溶液蒸于并充分灼烧,得到固体剩余物的组成可能是
A.NaCl B.NaCl、NaHCO3
C.NaCl、I2 D.NaCl、NaI、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
钠的化合物是中学化学常见物质,结合你掌握的化学知识,下列说法合理的是
A.锌粒与盐酸反应时,若加入适量氯化钠晶体,可明显加快反应速率
B.氯化钠中所含化学键为离子键,含离子键的化合物一定是离子化合物
C.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
D.氯化钠溶液导电是化学变化,而熔融态氯化钠导电是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法正确的是
A.用pH试纸测氯水的pH
B.用托盘天平称取5.72 g NaCl晶体
C.用酸式滴定管量取20.00 mL的酸性KMnO4溶液
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效果的是 ( )。
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com