
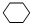
 ,名称是环己烷.
,名称是环己烷.分析 根据C元素、H元素守恒确定该烃的分子式为C6H12,不饱和度为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中不含不饱和键,该烃为环烷烃,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,说明分子中只有一种H原子,该烃为环己烷;
若该烃能使溴水褪色,说明分子中含有1个C=C双键,该烃属于烯烃,在催化剂作用下与H2发生加成反应,生成2,2-二甲基丁烷,则该烃的结构简式为(CH3)3C-CH=CH2.
解答 解:n(烃):n(C):n(H)=n(烃):n(CO2):2n(H2O)=0.1mol:0.6mol:0.6mol×2=1:6:12,即1个分子中含有6个C原子、12个H原子,故该烃的分子式为C6H12;
该烃的不饱和度为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中不含不饱和键,故该烃为环烷烃,其一溴取代物只有一种,说明分子中只有一种H原子,该烃为环己烷,结构简式为 ;
;
若该烃能使溴水褪色,说明分子中含有1个C=C双键,该烃属于烯烃,在催化剂作用下与H2发生加成反应,生成2,2-二甲基丁烷,则该烃的结构简式为(CH3)3C-CH=CH2,名称为:3,3-二甲基-1-丁烯,
故答案为:C6H12;环烷烃; ;环己烷;烯烃;(CH3)3C-CH=CH2; 3,3-二甲基-1-丁烯.
;环己烷;烯烃;(CH3)3C-CH=CH2; 3,3-二甲基-1-丁烯.
点评 本题考查有机物的推断,侧重于分子式的确定、烯烃的性质与命名等,比较基础,注意掌握燃烧法根据原子守恒确定有机物分子式,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO | |
| B. | 将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| C. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 | |
| D. | 用惰性电极电解MgCI2溶液:2 Cl-+2H2O=CI2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+2H2↑ | |
| B. | 铜片投入少量FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| C. | Ca(HCO3)2溶液与足量澄清石灰水混合:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 用铁棒作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A(g)+3B(g)?2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示,现象一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应发到平衡状态Ⅰ后,再升高温度,继续反应一段时间后达到平衡状态Ⅱ.下列叙述中正确的是( )
A(g)+3B(g)?2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示,现象一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应发到平衡状态Ⅰ后,再升高温度,继续反应一段时间后达到平衡状态Ⅱ.下列叙述中正确的是( )| A. | T1>T2,该反应生成物的总能量高于反应物的总能量 | |
| B. | 该反应在高温时才能自发进行 | |
| C. | 由平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化 | |
| D. | 反映从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g14CH4所含中子数目为8NA | |
| B. | 标准状况下,7.8g苯中含碳碳双键的数目为0.3 NA | |
| C. | 含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 | |
| D. | 0.1L 3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高压的条件下,有利于工业上氨气的合成 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com