
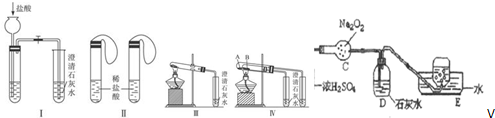
分析 (1)实验Ⅰ中,无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;碳酸钠和盐酸反应分两步进行,盐酸和碳酸钠、碳酸氢钠反应都生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;
(2)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解;Ⅳ
(3)B加热温度较低,可将碳酸氢钠在较低温度下加热,不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定;
(4)①碳酸氢钠与过量的氢氧化钙溶于反应生成碳酸钙沉淀和氢氧化钠;
②碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O;
(5)碳酸氢钠分解生成二氧化碳和水蒸气,二氧化碳、水蒸气与过氧化钠反应.
解答 解:(1)Ⅰ装置反应现象相同;Ⅱ装置,向碳酸钠溶液中滴加盐酸先没有气体生成,随着盐酸的不断滴加,后产生气泡,向碳酸氢钠溶液中滴加盐酸立即产生气泡,所以能够达到实验目的是Ⅱ,
故答案为:Ⅱ;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,生成的二氧化碳与澄清石灰水反应生成碳酸钙,反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O;
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,
故答案为:NaHCO3;
(4)①碳酸氢钠与过量的氢氧化钙溶于反应生成碳酸钙沉淀和氢氧化钠,其反应的离子方程式为:Ca2++OH-+HCO3-═CaCO3↓+H2O;
故答案为:Ca2++OH-+HCO3-═CaCO3↓+H2O;
②碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,则所得溶液中溶质的化学式为Na2CO3;
故答案为:Na2CO3;
(5)碳酸氢钠分解生成二氧化碳和水蒸气,二氧化碳、水蒸气与过氧化钠反应,其反应的方程式为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2 O=4NaOH+O2.
故答案为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2 O=4NaOH+O2.
点评 本题考查了碳酸钠和碳酸氢钠的性质,注意装置与物质性质的关系,明确碳酸钠和盐酸反应分两步进行为解答的关键,侧重二者与酸的反应及稳定性比较的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 20mL 0.3mol/L的硫酸溶液 | B. | 30mL 0.2mol/L的硫酸溶液 | ||
| C. | 20mL 0.2mol/L的硫酸溶液 | D. | 10mL 0.4mol/L的硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol K2O2中含有的阴、阳离子总数是4NA | |
| B. | 0.2molO3与6.72LO2均含有0.6NA个氧原子 | |
| C. | 常温常压下,22g P4O6与P4O10的混合物中含有氧原子的数目为0.6NA | |
| D. | 10gD216O所含的中子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.062 mol/L | B. | 0.62 mol/L | C. | 6.2mol/L | D. | 62mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com