
【题目】某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:_______________________________________。
【实验验证】实验装置及实验中使用的试剂如图:

在装入药品前,甲同学检查装置A 的气密性,方法是________________________________________。
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设_____,理由是______________________________________________________。
(3)如果假设3 正确,填写下表中的实验现象:
装置 | B | F | G |
实验现象 | _____ | _____ | _____ |
装置C 的作用是___________________________,写出装置C中发生反应的离子方程式__________________________________________________。
(5)装置D 的作用是________________________________________。
【答案】 【提出假设】气体生成物是SO2和H2 的混合气体 打开弹簧夹K1、K2、K3、K4,关闭分液漏斗活塞,将干燥管小口端连接一橡皮管并浸入水中,用酒精灯给圆底烧瓶微热,若末端的橡皮管出现连续而均匀气泡时,说明装置A 的气密性良好 2 浓硫酸具有强氧化性,在加热的条件下能被金属还原为SO2 品红溶液红色褪去 黑色固体变成红色 无水硫酸铜变蓝 除去可能未反应完的SO2 5SO2 +2MnO4- +2H2O==5SO42- +2Mn2+ + 4H+ 检验SO2 是否已除尽
【解析】【提出假设】假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
推断当金属过量时,且金属较活泼则生成的气体中可能含有氢气,所以假设3为:气体产物有SO2和H2 ;
【实验验证】
(1)在装入药品前,甲同学检查装置A的气密性需要密闭装置A,利用分液漏斗中加入水,观察液面变化,设计方法为:关闭弹簧夹K1,打开分液漏斗活塞,向分液漏斗中注入适量水,若分液漏斗滴下水的速度逐渐变慢,直至停止,则证明装置A的气密性良好;
(2)浓硫酸的性质可知,和金属加热条件下发生反应开始生成二氧化硫气体,当金属过量时,且金属较活泼则生成的气体中可能含有氢气,假设2一定是错误的;
(3)若生成的气体为二氧化硫和氢气,则装置中的反应现象为:二氧化硫具有漂白性通过装置B中品红溶液褪色,氢气通过装置F还原氧化铜为金属铜,出现黑色变为红色现象,生成的水蒸气通过装置G,无水硫酸铜白色变化为蓝色;为检验二氧化硫的存在和避免二氧化硫对后续实验的影响,通过装置C是利用二氧化硫的还原性被高锰酸钾溶液氧化除去,发生反应的离子方程式为5SO2 +2MnO4- +2H2O==5SO42- +2Mn2+ + 4H+;
(5)装置D中的品红溶液是检验二氧化硫是否除净。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途。如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
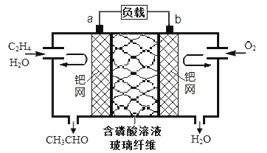
A. 该电池电极a为正极,b为负极
B. 电子移动方向:电极a→磷酸溶液→电极b
C. 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+
D. b电极有2.24LO2反应,溶液中有0.4molH+迁移到b电极上反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 溶解度大的化合物一定是强电解质
B. 胶体与溶液的本质区别是分散剂粒子大小的不同
C. 物质在发生化学反应的过程中,都伴随着能量的变化
D. 金属的冶炼必须在高温下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定质量CaCl2和HCl的混合溶液中逐滴加入浓度为1.000 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
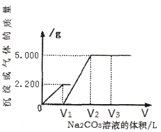
(1)样品中物质的量之比n (CaCl2) :n(HCl)=_____________。
(2)V2=_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒盛装,该溶液的体积应为
A. 10mL B. 40mL C. 大于40mL D. 小于40mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g)+B(g)![]() 2C(g) △H<0,A、C的物质的量随时间变化的关系如右表所示。下列有关说法正确的是
2C(g) △H<0,A、C的物质的量随时间变化的关系如右表所示。下列有关说法正确的是

A. x=1
B. 反应开始2min内,用B表示的反应速率为0.05mol · L-l · min -1
C. 反应进行到lmin时,反应体系达到化学平衡状态
D. A的正反应速率等于C的逆反应速率时,反应体系达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH=-Q1;
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2;
H2O(g)=H2O(l) ΔH=-Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2 B.4Q1+Q2+10Q3 C.4Q1+2Q2 D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 相同体积、相同浓度的氨水和NaOH溶液中和盐酸的能力相同
B. 醋酸溶液中只存在一个电离平衡体系
C. 0.1mol · L-1的氨水能使酚酞试液变红,说明氨水是弱电解质水溶液
D. 同浓度同体积的醋酸和盐酸分别与足量镁反应时,放出H2的速率相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com