
| A. | 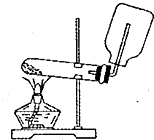 实验室制取并收集氨气 | B. | 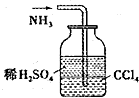 吸收氨气 | ||
| C. | 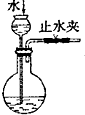 代替启普发生器 | D. | 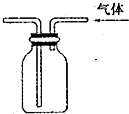 排空气法收集二氧化碳 |
分析 A.收集氨气时集气瓶口应塞一团棉花;
B.四氯化碳的密度大,可隔绝氨气与稀硫酸;
C.启普发生器能使固体与液体分离;
D.二氧化碳的密度比空气的密度大.
解答 解:A.收集氨气时集气瓶口应塞一团棉花,则图中装置可反应生成氨气,但不能收集氨气,故A错误;
B.四氯化碳的密度大,可隔绝氨气与稀硫酸,则图中装置可吸收氨气,防止倒吸,故B正确;
C.启普发生器能使固体与液体分离,而图中装置关闭止水夹难实现固体与液体分离,故C错误;
D.二氧化碳的密度比空气的密度大,则图中应长导管进气收集,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握气体的制备实验、仪器的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
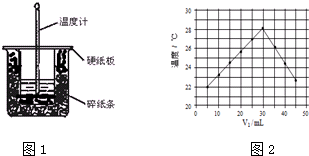
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
| 3 | 25.1 | 25.1 | 25.1 | 33.6 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
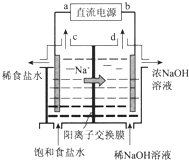 用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:
用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有KNO3,肯定没有Na2CO3 | B. | 肯定没有Ba(NO3)2,可能有KNO3 | ||
| C. | 肯定有KNO3,可能还有Na2CO3 | D. | 肯定没有Na2CO3和Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
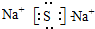 .
.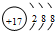 ,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.
,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③⑤⑧⑨ | C. | ⑥⑧⑨ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com