
��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2 mol��N2��0.6 mol��H2����һ�������·������·�Ӧ�� N2(g)��3H2(g)![]() 2NH3(g) ��H ��0
2NH3(g) ��H ��0
��1���÷�Ӧ450���ƽ�ⳣ�� 500��ʱ��ƽ�ⳣ�����>������<����=������
��2��������������˵��������Ӧ�Ѵ�ƽ�����
a��3v����H2����2v����NH3�� b�������������ƽ����Է���������ʱ����仯
c��������������ܶȲ���ʱ����仯 d������������ķ�����������ʱ����仯
��3��������Ӧ����5����ʱ�ﵽƽ�⣬���NH3�����ʵ���Ϊ0.2mol
����ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(N2)Ϊ mol/(L��min)
��4�����������������䣬����ʼͶ����Ϊa molN2��b molH2 ��c molNH3��Ҳ�ɵõ���������ͬ��ƽ�⣬��a��b��c�������ϵʽ�� ������������ ��
��5����5����ĩ������������������, ������ͨ��0.2 mol��N2��0.6 mol��H2��
��ƽ�� �ƶ����������Ӧ�������淴Ӧ����������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| ���� |
| ���¸�ѹ |
| ���� ��� |
��ʼʱ�����ʵ����ʵ���/mol | ��Ӧ��ƽ��ʱ���ʱ�/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | ��H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | ��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?�㶫ģ�⣩��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
��2013?�㶫ģ�⣩��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺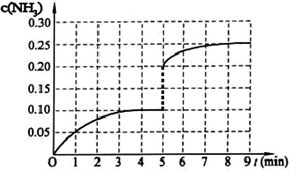

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c |
| 2 |
| 3c |
| 2 |
| c |
| 2 |
| 3c |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��12�֣�������һ�ֵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���塣��1����ͼ��1 mol NO2��1 mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
��2����֪��N2(g)+ O2(g)=2 NO(g) ��H = ��180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) ��H = - 746 kJ • mol-1
��ӦCO(g) +![]() O2(g) = CO2(g)�ġ�H = kJ• mol-1
O2(g) = CO2(g)�ġ�H = kJ• mol-1
��3����һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6 mol��H2����һ�������·������·�Ӧ�� N2(g)��3H2(g)![]() 2NH3(g) ��H ��0������5����ʱ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol��ƽ��ʱH2��ת����Ϊ ���÷�Ӧ��ƽ�ⳣ������ʽK = ��
2NH3(g) ��H ��0������5����ʱ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol��ƽ��ʱH2��ת����Ϊ ���÷�Ӧ��ƽ�ⳣ������ʽK = ��
(4) �ڹ̶�������ܱ������У�1.0��103 kPaʱ��Ӧ N2(g)+3H2(g) 2NH3(g)
2NH3(g)
��H<0 ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 51 | K1 | K2 |
��K1 K2�������������=��������
�����и�����˵�������ϳɰ���Ӧһ���ﵽƽ��״̬���� ������ĸ��
a��������N2��H2��NH3��Ũ��֮��Ϊ1:3:2 b��NH3��Ũ�ȱ��ֲ���
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com