
| A. | 一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) | |
| B. | 在常温下,10 mL 0.2 molL-1盐酸与10 mL 0.2 molL-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13 | |
| C. | 在0.1 molL-1 NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-) | |
| D. | 5 mL 1 molL-1 CH3COONa溶液与5 mL 1 molL-1盐酸混合液中c(Cl-)=c(Na+)>c(H+)>c(OH-) |
分析 A.醋酸钠是强碱弱酸盐,醋酸根离子水解水解溶液呈碱性;
B.根据n=cV计算出盐酸和氢氧化钡的物质的量,然后计算出反应后溶液中氢氧根离子浓度,再根据水的离子积计算出溶液氢离子浓度,最后计算出溶液的pH;
C.根据氯化铵溶液中的电荷守恒判断;
D.反应后溶质为等浓度的氯化钠和醋酸,醋酸部分电离,溶液呈酸性,据此判断离子浓度大小.
解答 解:A.醋酸钠是强碱弱酸盐水解,CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+),溶液呈碱性,可使酚酞试液变红,故A正确;
B.在常温下,10 mL 0.2 mol•L-1盐酸中含有0.002molHCl,10 mL 0.2 mol•L-1 Ba(OH)2溶液中含有0.002mol氢氧化钡,充分混合后氢氧化钡过量,混合液中氢氧根离子浓度为:$\frac{0.002mol×2-0.002mol}{0.02L}$=0.1mol/L,混合溶液的pH=13,故B正确;
C.在0.1 mol•L-1 NH4Cl溶液中,根据电荷守恒可知:c(H+)+c(NH4+)=c(Cl-)+c(OH-),故C错误;
D.5mL 1 mol•L-1 CH3COONa溶液与5 mL 1 mol•L-1盐酸混合,溶质为等浓度的NaCl和醋酸,溶液呈酸性,溶液中离子浓度大小为:c(Cl-)=c(Na+)>c(H+)>c(OH-),故D正确;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握核电荷数、盐的水解原理在判断离子浓度大小中的应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
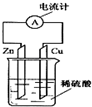 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 该装置将电能转变为化学能 | B. | 电流从锌片经导线流向铜片 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物放在冰箱中会减慢食物变质的速率 | |
| B. | 钾的金属性强,所以钾与水的反应比钠的反应剧烈 | |
| C. | 2mol SO2与1mol O2混合反应后一定能生成2 mol SO3 | |
| D. | 面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gN2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4 L N2含有的分子数目为NA | |
| C. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 改变条件 | 平衡移动方向 | pH | 水电离出的c(H+) | KW |
| 升温 | ||||
| 通入HCl气体 | ||||
| 加入NaOH固体 | ||||
| 加入NH4Cl固体 | ||||
| 加入金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3 | (1)在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 | (2)白色浑浊物是BaSO4,主要 原因是Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 | 反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊; (3)通入纯净的CO2的目的防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com