
分析 (1)二氧化硅与氢氧化钠反应生成硅酸钠和水,硅酸钠与盐酸反应生成氯化钠和硅酸;
二氧化硅与碳反应生成硅和一氧化碳,硅与氯气反应生成四氯化硅,四氯化硅被氢气还原生成硅和氯化氢;
(2)依据二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠溶液,硅酸钠具有粘性解答.
解答 解:(1)二氧化硅与氢氧化钠反应生成硅酸钠和水,硅酸钠与盐酸反应生成氯化钠和硅酸,化学方程式:SiO2+2NaOH═Na2SiO3+H2O Na2SiO3+2HCl═H2SiO3↓+2NaCl;
故答案为:SiO2+2NaOH═Na2SiO3+H2O Na2SiO3+2HCl═H2SiO3↓+2NaCl;
(2)二氧化硅与碳反应生成硅和一氧化碳,硅与氯气反应生成四氯化硅,四氯化硅被氢气还原生成硅和氯化氢,发生反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO2↑;Si(粗硅)+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4;SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl;
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO2↑;Si(粗硅)+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4;SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl;
(2)玻璃的主要成分是SiO2,它与强碱(NaOH)反应生成的Na2SiO3是一种黏结剂,能使瓶口和塞子粘结在一起,所以实验室中盛放强碱(氢氧化钠)溶液的玻璃试剂瓶不能用玻璃塞;
故答案为:玻璃的主要成分是SiO2,它与强碱(NaOH)反应生成的Na2SiO3是一种黏结剂,能使瓶口和塞子粘结在一起.
点评 本题考查了化学方程式书写,明确硅及其化合物性质是解题关键,注意粗硅提纯及碱液的保存,题目难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
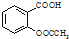 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
| 名称 | 相对分子质量 | 熔点或沸点 (℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙烯水杨酸 | 180 | 135(熔点) | 微溶 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中或熔融状态下能导电的物质 | |
| B. | 凡在水中能生成离子因而能导电的物质 | |
| C. | 氧化钠溶于后水溶液能导电,但溶液中的离子并非本身电离,因而氧化钠是非电解质 | |
| D. | 在水溶液里或熔融状态下本身能电离出阳离子和阴离子,因而是能导电的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+H2O | B. | Fe+H2O(g) | C. | CO2+H2O | D. | Na2O2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 16.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$ mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5 g的35Cl2气体的体积为2.24 L | |
| D. | 35Cl2气体的摩尔质量为70 g•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com