
【题目】如图是一种利用锂电池“固定 CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将 CO2转化为 C 和 Li2CO3,充电时选用合适催化剂会释放出 CO2。下列说法正确的是
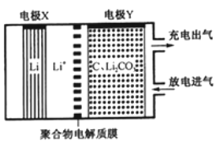
A.该电池放电时,Li+向电极 X 方向移动
B.该电池放电时,每转移 4 mol 电子,理论上生成 1mol C
C.该电池充电时,电极Y 与外接直流电源的负极相连
D.该电池充电时,阳极反应式为:C+2Li2CO3-4e- = 3CO2↑+4Li+
【答案】BD
【解析】
放电时,X极上Li失电子变成Li+,则X为负极,Y为正极,正极上CO2得电子生成C和Li2CO3;充电时,阴极上Li+得电子生成Li,阳极上C失电子生成二氧化碳,即C+2Li2CO3-4e-═3CO2↑+4Li+,据此分析解答。
A.放电时,X极上Li失电子,X为负极,Y为正极,Li+向电极Y方向移动,故A错误;
B.放电时,正极上CO2得电子生成C和Li2CO3,电极反应式为3CO2+4Li++4e-═C+2Li2CO3,C的化合价降低4价,则每转移4mol电子,理论上生成1mol C,故B正确;
C.该电池充电时,电源的负极与外加电源的负极相连,即电极X与外接直流电源的负极相连,故C错误;
D.该电池充电时,阳极上C失电子生成二氧化碳,电极反应式为C+2Li2CO3-4e-═3CO2↑+4Li+,故D正确;
故选BD。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
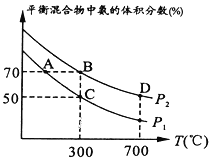
①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“>”“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
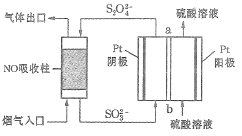
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的![]() 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫在生产和生活中有着广泛的用途。
(1)SO2可用来制备定影剂Na2S2O3,,反应的化学方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑。请用单线桥表示该反应中的电子转移情况______,还原剂与氧化剂的物质的量之比为____。
(2)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为______;吸收后的浓溶液可用图1的装置再生循环脱硫,并制得硫酸,电极a的电极反应为_____,乙是____。
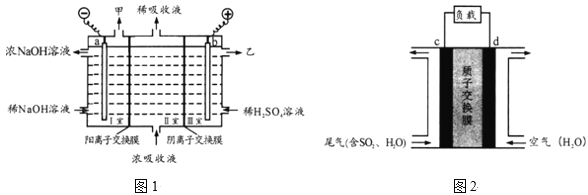
(3)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是______,c电极是__极,移动的离子及方向是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,可采取的措施为( )
A.通入二氧化碳气体B.加入氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员利用Cu/ZnO作催化剂,在光照条件下实现了CO2和H2合成CH3OH,该反应历程示意图如下。
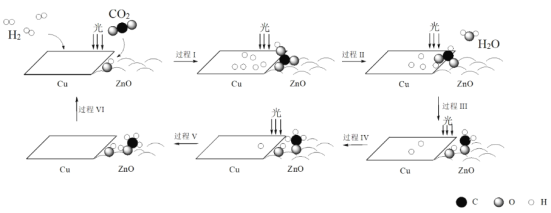
下列说法不正确的是
A.过程I中ZnO表面上进行CO2的吸附与转化
B.过程II中存在极性键的断裂与形成
C.过程V中生成CH3OH时吸收能量
D.总反应的化学方程式是CO2 + 3H2![]() CH3OH + H2O
CH3OH + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2可转化成有机物实现碳循环。在容积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
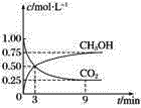
(1)从3 min到9 min,v(H2)=________ mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是________(填字母)。
A 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B 混合气体的密度不随时间的变化而变化
C 单位时间内消耗3 mol H2,同时生成1 mol H2O
D CO2的体积分数在混合气体中保持不变
(3)一定温度下,第9 min时v逆(CH3OH)________(填“大于”“小于”或“等于”)第3 min时v正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_____区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_____,1mol [Co(NH3)5Cl]Cl2中含σ键数目为___ NA。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是______________。![]() 的空间构型是________________,HPO3中心原子的杂化方式是_________________。
的空间构型是________________,HPO3中心原子的杂化方式是_________________。
(3)PH3是_____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是____。
(4)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如下图。S2-的配位数是______;若硫化锂晶体的密度为a g·cm -3,则距离最近的两个S2-的距离是_____nm。(用含 a、M、NA的计算式表示)。
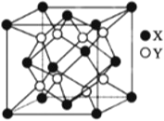
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是

A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)中,表示该反应速率最快的是:
3C(g)+4D(g)中,表示该反应速率最快的是:
A.V(A)=0.5mol·L-1·s-1B.V(B)=0.3mol·L-1·s-1
C.V(C)=0.8mol·L-1·s-1D.V(D)=1mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com