

分析 (1)软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2),加入浓盐酸加热反应生成氯化锰,氯气和水,样品中的二氧化硅不溶;
(2)依据氯气的密度大于空气的密度分析;
(3)依据化学方程式计算得到;
(4)铁在氯气中燃烧生成红褐色烟氯化铁固体小颗粒;
(5)依据氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性分析;
(6)氯气和水反应生成次氯酸和氯化氢;
(7)氯气是黄绿色有毒气体,密度比空气大,且氯气的溶解性较小,1体积的水能溶解2体积的氯气,氯气能和水反应生成酸,所以氯气能和碱反应生成盐和水.
解答 解:(1)软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2),加入浓盐酸加热反应生成氯化锰,氯气和水,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成的氯化锰溶于水,样品中的二氧化硅不溶,所以烧瓶中残留的固体是二氧化硅固体;
故答案为:石英(SiO2);
(2)氯气的密度大于空气的密度,收集氯气的方法是向上排气法收集,导气管长进短处,图1导管的a接口与图2的导管的b接口连接;
故答案为:b;
(3)若生成标准状况下11.2LCl2,物质的量为0.5mol,化学反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,则参加反应的MnO2的物质的量为0.5mol;
故答案为:0.5;
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟,是铁在氯气中燃烧生成氯化铁的反应过程,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(5)按图3进行实验,观察到B中干燥的有色布条不褪色,说明氯气无漂白性,C中湿润的有色布条褪色,氯气和水反应生成的次氯酸具有漂白性;
故答案为:氯气无漂白性,起漂白性的物质是HClO;
(6)氯气和水反应的化学方程式为:Cl2+H2O?HCl+HClO;
故答案为:Cl2+H2O?HCl+HClO;
(7)A、氯气的密度大于空气的密度,所以和空气混合时,氯气在下方,空气在上方,所以发生氯气泄漏时,不能向地势低的地方撤离,应向高处疏散,故A正确;
B、氯气的密度大于空气的密度,所以和空气混合时,氯气在下方,空气在上方,所以发生氯气泄漏时,不能向地势低的地方撤离,应向高处疏散,故B错误;
C、氯气能和水反应生成酸,所以氯气能和碱反应生成盐和水,关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位,避免氯气逸出,故C正确;
D、氯气水中的溶解性较小,关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位,不能很好的吸收氯气,故D错误;
故选AC.
点评 本题考查了实验室制备氯气的分析,氯气性质的分析应用,掌握基础是关键,题目较简单.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 水蒸气变为液态水时,焓变△H<0 | |
| B. | 对于△H<0的反应,反应物的总焓大于生成物的总焓 | |
| C. | 需要持续加热才能进行的反应△H一定大于0 | |
| D. | Ba(OH)2•8H2O和NH4Cl固体反应,反应物的总键能小于生成物的总键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
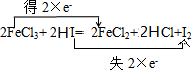 ,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.
,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的原子核外电子数为53 | |
| B. | ${\;}_{53}^{131}$I与${\;}_{53}^{127}$I互为同位素 | |
| C. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| D. | ${\;}_{53}^{131}$I与${\;}_{53}^{127}$I为同种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 非金属单质中,一定有σ键,可能有π键 | |
| D. | 一个N2分子中有1个σ键,2个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应说明它是吸热反应 | |
| B. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出的热量多 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l),△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1.1 mol NaOH的稀溶液混合,放出的热量等于 57.3 kJ | |
| D. | 1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=-297.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | z=4 | B. | B 的转化率是40% | ||
| C. | A 的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来压强的0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com