
分析 氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被空气中氧气氧化,现象为白色絮状沉淀迅速变为灰绿色,最终变为红褐色,生成氢氧化铁,如制备氢氧化铁,可用氯化铁与氢氧化钠反应生成,氢氧化铁与氢氧化亚铁相比较,氢氧化铁较稳定,以此解答该题.
解答 解:取3mL FeCl2溶液于试管中,用长滴管吸取3mL NaOH溶液,将长滴管尖嘴部分插入FeCl2溶液的底部后,快速挤出NaOH溶液,观察试管里的变化,现象是生成白色沉淀;离子方程式为 Fe2++2OH-=Fe(OH)2↓.然后将上述溶液倒入表面皿,与空气充分接触,观察现象:白色絮状沉淀迅速变为灰绿色,最终变为红褐色,化学方程式 4Fe(OH)2+O2+2H2O=4Fe(OH)3,该反应类型为化合反应.
氢氧化铁的形成:取少量FeC13溶液于试管中,滴入NaOH溶液,现象生成红褐色沉淀,离子方程式为Fe3++3OH-=Fe(OH)3↓.
得出结论:氢氧化铁较稳定.
故答案为:生成白色沉淀;Fe2++2OH-=Fe(OH)2↓;白色絮状沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;化合反应;红褐色沉淀;Fe3++3OH-=Fe(OH)3↓;Fe(OH)3.
点评 本题考查Fe的化学性质,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重化学反应及现象的考查,注意现象与反应的对应关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用胶头滴管向试管滴液体时,滴管尖端与试管内壁 | |
| B. | 过滤操作中,漏斗颈与烧杯内壁 | |
| C. | 分液操作中,分液漏斗颈与烧杯内壁 | |
| D. | 过滤操作中,玻璃棒与三层滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生电化腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 氢氧燃料电池的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 铜上镀锌时,与电源正极相连的是纯铜 | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有(1)(2) | B. | 只有(1)(2)(3) | C. | 只有(4)(5) | D. | 全不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
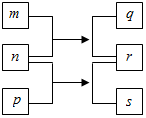 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径:X>Y>Z | |
| B. | 氧化性:r>m | |
| C. | p和q中均含有离子键 | |
| D. | 等体积等浓度的q溶液与s溶液反应后,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
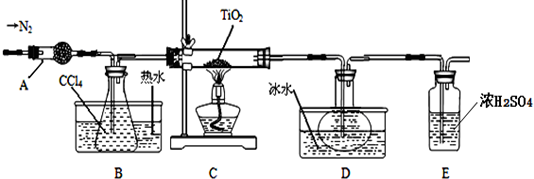
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com