
| A、碳酸钠用于治疗胃溃疡病人的胃酸过多症 |
| B、Na2O2用作呼吸面具的供氧剂 |
| C、明矾用于净化生活用水 |
| D、Fe2O3用于制作红色染料 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
 已知:4NH3+5O2
已知:4NH3+5O2 | 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
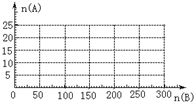
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由反应①、②可推知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ?mol-1 |
| B、等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等 |
| C、若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ |
| D、若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | c(HCl/mol/L) | 温度/℃ | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 粉末状 |
| 4 | 2.5 | 30 | 粉末状 |
| A、4-3-2-1 |
| B、1-2-3-4 |
| C、3-4-2-1 |
| D、1-2-4-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com