
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
分析 根据乙醇沸点低,易挥发,故可以易被检测及乙醇具有还原性,K2Cr2C7具有强氧化性,可以氧化乙醇,自身生成Cr3+来分析解答.
解答 解:①乙醇沸点低,易挥发,若饮酒,呼出的气体中含有酒精,与测定原理有关;
②乙醇密度比水小,可与水以任意比混溶,与测定原理无关;
③乙醇分子中含有羟基,具有还原性,K2Cr2C7具有强氧化性,可以把乙醇迅速氧化为乙酸同时生成蓝绿色的Cr3+,与测定原理有关;
④乙醇可看成是乙烷中的氢原子被羟基取代后的产物,是烃的含氧化合物,与测定原理无关;
故对乙醇的描述与此测定原理有关的是①③;
故选A.
点评 本题主要考查乙醇的性质,难度不大,本题中的信息交警对驾驶员进行呼气酒精检测的原理是解答的关键,学生应学会信息的抽取和应用来解答习题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1molNH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①④ | C. | ③⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸与食用醋有相同的气味 | |
| B. | 乙烯、氯乙烯、苯乙烯都可用于合成有机高分子材料 | |
| C. | 苯能与溴发生反应,因此不能用苯萃取溴水中的溴 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖,因此二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是焓变为负值 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为CO2(g)+H2(g) $?_{高温}^{催化剂}$ CO(g)+H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
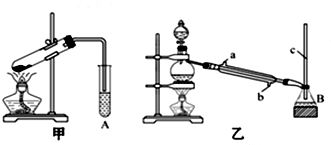
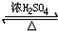 HCO18OCH3+H2O.
HCO18OCH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.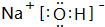 或
或 等,一种共价化合物的电子式为
等,一种共价化合物的电子式为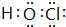 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在人体内,油脂的主要反应是在脂肪酶催化下水解为高级脂肪酸和甘油 | |
| B. | 鉴别蚕丝和人造丝(纤维素)的方法之一是灼烧,有烧焦羽毛气味的是蚕丝 | |
| C. | 农村兴建沼气池将秸秆发酵产生沼气,可减少因焚烧带来的环境污染 | |
| D. | 氮、磷是作物生长的重要元素,故含氮、磷的废水可直接排放到湖泊中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com