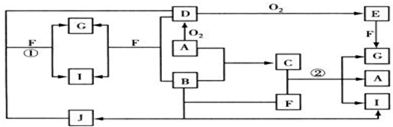
解:已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成,突破口在固体单质A
能够被连续氧化,A和氧气反应生成D为气体,说明A为固体非金属单质,依据所学可知A为S,D为SO
2;E为SO
3;G为H
2SO
4;A和G的浓溶液加热时反应生成D和F,F为H
2O;依据B+D→G+I,生成硫酸和盐酸,说明是二氧化硫被氧化为硫酸,已知A、B为同周期相邻元素的单质,则B为Cl
2;根据各物质间的相互转化关系,结合所学知识,A、B、D、E、F、G、I、J分别为S,Cl
2,SO
2,SO
3,H
2O,H
2SO
4,HCl,HClO;又根据(4)中“若反应②生成的H
2SO
4、S、HCl的物质的量之比为1:2:6”,所以C为SCl
2,
(1)根据推断可知B的化学式为Cl
2;E为SO
3;F为H
2O,结构式为:H-O-H,故答案为:Cl
2;SO
3;H-O-H;
(2)反应①的离子方程式为D+J+F→G+I,SO
2+HClO+H
2O→H
2SO
4+HCl,配平后书写反应的离子方程式为:HClO+SO
2+H
2O=3H
++SO
42-+Cl
-,
故答案为:HClO+SO
2+H
2O=3H
++SO
42-+Cl
-;
(3)足量铁与H
2SO
4的热的浓溶液反应,开始是生成二氧化硫气体,随着反应进行浓硫酸变稀后,过量的铁和稀硫酸反应生成氢气,所得气体是二氧化硫和氢气,铁与氯气反应的化学方程式为:2Fe+3Cl
2
2FeCl
3,故答案为:SO
2、H
2;2Fe+3Cl
2
2FeCl
3;
(4)C是一种重要的化工产品,为易挥发的樱桃红色液体,若反应②中生成的G、A和I的物质的量之比为1:2:6,C+F→G+A+I,C+4H
2O→H
2SO
4+2S+6HCl;依据化学反应的原子守恒,则C为SCl
2,电子式为
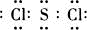
,反应②的化学方程式为:3SCl
2+4H
2O=H
2SO
4+2S↓+6HCl,故答案为:
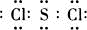
;3SCl
2+4H
2O=H
2SO
4+2S↓+6HCl.
分析:已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成,突破口在固体单质A
能够被连续氧化,A和氧气反应生成D为气体,说明A为固体非金属单质,依据所学可知A为S,D为SO
2;E为SO
3;G为H
2SO
4;A和G的浓溶液加热时反应生成D和F,F为H
2O;依据B+D→G+I,生成硫酸和盐酸,说明是二氧化硫被氧化为硫酸,已知A、B为同周期相邻元素的单质,则B为Cl
2;根据各物质间的相互转化关系,结合所学知识,A、B、D、E、F、G、I、J分别为S,Cl
2,SO
2,SO
3,H
2O,H
2SO
4,HCl,HClO;又根据(4)中“若反应②生成的H
2SO
4、S、HCl的物质的量之比为1:2:6”,所以C为SCl
2,3SCl
2+4H
2O=H
2SO
4+2S↓+6HCl,其他问题迎刃而解.
点评:本题考查了元素化合物的性质转化关系和性质应用,主要是题干条件和转化关系的特征反应,题目较难,熟练掌握元素化合物的性质是解题关键.

 2FeCl3,故答案为:SO2、H2;2Fe+3Cl2
2FeCl3,故答案为:SO2、H2;2Fe+3Cl2 2FeCl3;
2FeCl3;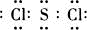 ,反应②的化学方程式为:3SCl2+4H2O=H2SO4+2S↓+6HCl,故答案为:
,反应②的化学方程式为:3SCl2+4H2O=H2SO4+2S↓+6HCl,故答案为: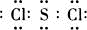 ;3SCl2+4H2O=H2SO4+2S↓+6HCl.
;3SCl2+4H2O=H2SO4+2S↓+6HCl.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案


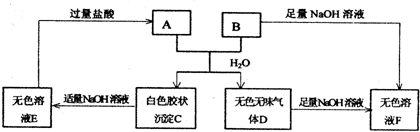
 (2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁

 甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.