
| A、浓盐酸 |
| B、浓H2SO4 |
| C、浓硝酸 |
| D、稀硝酸 |
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:

c(OH-)?c(N
| ||
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(H+) |
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,543.4g |
| C、950mL,572g |
| D、500mL,286g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ③
③ ④
④ ⑤
⑤ ⑥
⑥
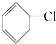 ⑧
⑧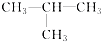 ⑨
⑨ ⑩
⑩ ?
? ?CH3Cl
?CH3Cl查看答案和解析>>
科目:高中化学 来源: 题型:
| A、目前使用的燃料液化石油气,其主要成分均属于烃 |
| B、油脂、纤维素、蛋白质都是高分子化合物 |
| C、石油裂解、煤的气化、海水制镁都包含化学变化 |
| D、食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
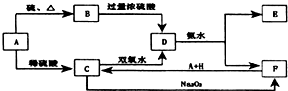 中学化学中几种常见物质的转化关系如图所示:
中学化学中几种常见物质的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2?2NH3△H<0.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2?2NH3△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能够发生有效碰撞的分子一定是活化分子 |
| B、增大浓度,单位体积内活化分子数增加,化学反应速率增大 |
| C、加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D、一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com