
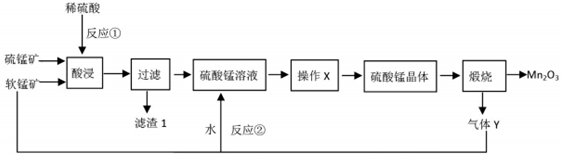
分析 软锰矿和硫锰矿在稀硫酸中酸浸,发生反应①,得到滤渣,含有S,过滤得到滤液中含硫酸锰和稀硫酸,经过操作X得到硫酸锰晶体,可知操作X使硫酸锰溶液冷却结晶出了硫酸锰晶体,晶体经过煅烧得到三氧化二锰,产生气体Y,为SO2,气体Y和软锰矿在水中反应得到硫酸锰溶液,并入主流程中,有效避免了SO2气体污染大气,据此分析;
(1)MnO2是两性化合物,在酸性条件之下是一种氧化剂,根据流程图分析,MnO2和MnS在稀硫酸中反应生成一种非金属单质,即滤渣1,同时产生MnSO4,是一个氧化还原反应,据此写出反应的离子方程式;
(2)根据流程图,MnSO4溶液经过操作X变成MnSO4•H2O晶体,操作X为蒸发浓缩、过滤、洗涤干燥,用乙醇洗涤MnSO4•H2O晶体,则是为了冷却结晶,降低晶体的溶解,同时考虑到乙醇易挥发,很容易除去;
(3)煅烧硫酸锰晶体,产生一种污染空气气体Y,根据元素守恒判断,为SO2,SO2和软锰矿在水中反应生成硫酸锰溶液,据此写出反应②的化学方程式;
(4)用0.2000mol/L的标准BaCl2溶液测定流程图中MnSO4•H2O晶体样品的纯度(杂质不与BaCl2反应),主要是和晶体中的SO42-反应,根据元素守恒计算;
(5)Mn2O3在空气中加热到940℃以上时,会分解生成氧气和另一种锰的氧化物,根据质量守恒和元素守恒计算.
解答 解:(1)MnO2是两性化合物,在酸性条件之下是一种氧化剂,根据流程图分析,MnO2和MnS在稀硫酸中反应生成一种非金属单质,即滤渣1,同时产生MnSO4,是一个氧化还原反应,则“酸浸”时反应①的离子反应方程式为:MnO2+4H++MnS═S+2Mn2++2H2O,
故答案为:MnO2+4H++MnS═S+2Mn2++2H2O;
(2)根据流程图,MnSO4溶液经过操作X变成MnSO4•H2O晶体,操作X为蒸发浓缩、过滤、洗涤干燥,用乙醇洗涤MnSO4•H2O晶体,则是为了冷却结晶,降低晶体的溶解,同时考虑到乙醇易挥发,很容易除去,则常用酒精洗涤MnSO4•H2O晶体,主要目的是:冷却结晶,减少MnSO4•H2O晶体的溶解,乙醇易挥发便于除杂,
故答案为:冷却结晶,减少MnSO4•H2O晶体的溶解,乙醇易挥发便于除杂;
(3)煅烧硫酸锰晶体,产生一种污染空气气体Y,根据元素守恒判断,为SO2,SO2和软锰矿在水中反应生成硫酸锰溶液,则反应②的化学方程式为MnO2+SO2═MnSO4,
故答案为:MnO2+SO2═MnSO4;
(4)用0.2000mol/L的标准BaCl2溶液测定流程图中MnSO4•H2O晶体样品的纯度(杂质不与BaCl2反应),主要是和晶体中的SO42-反应,取样品ag,若消耗标准溶液50.00ml,根据S元素守恒,样品中含有MnSO4•H2O的物质的量为n=0.2000mol/L×50.00×10-3L=0.01mol,则样品中含有的MnSO4•H2O晶体的质量为m=0.01mol×169g/mol=1.69g,所以ag样品中的纯度为$\frac{m}{a}×100%$=$\frac{169}{a}%$,
故答案为:$\frac{169}{a}%$;
(5)Mn2O3在空气中加热到940℃以上时,会分解生成氧气和另一种锰的氧化物,47.4g Mn2O3按上述反应分解生成1.6g氧气,根据质量守恒,产生的锰的氧化物的质量为47.4g-1.6g=45.8g,47.4gMn2O3中含有Mn的质量为$47.4g×\frac{110}{158}$=33g,根据Mn元素守恒,则分解产物锰的氧化物中也应含有Mn的质量为33g,含有O的质量为45.8g-33g=12.8g,所以锰的氧化物中,含有Mn的物质的量为n(Mn)=$\frac{33g}{55g/mol}=0.6mol$,含有O的物质的量为n(O)=$\frac{12.8g}{16g/mol}=0.8mol$,则n(Mn):n(O)=3:4,因此化学式为Mn3O4(或MnO2•2MnO),
故答案为:Mn3O4(或MnO2•2MnO).
点评 本题考查Mn族元素的性质,结氧化还原反应方程式的书写和配平,结合流程图分析,明确流程图中每一步操作的含义,结合守恒思想进行分析计算可以起到简便的作用,题目难度不大.事实上,学过大学无机化学的会知道,对于Mn,Mn2O3处于中间价态,不稳定,很容易变成MnO2和MnO,MnO2是两性的,酸中起氧化剂作用,碱中起还原剂作用,本题(1)中MnO2其实并不与稀的H2SO4反应,会和浓硫酸反应产生O2,这是易错点.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 鉴别1-溴丙烷和2-溴丙烷能通过核磁共振仪鉴别,不能用红外光谱仪鉴别 | |
| B. | 仅用物理方法无法鉴别乙醇、甲苯、硝基苯 | |
| C. | 仅用一种试剂能鉴别乙醇、苯、苯酚、2-己烯和四氯化碳 | |
| D. | 用KMnO4酸性溶液能鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
 .
. .
. (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
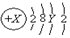 ,则X、Y及该原子3d能级上的电子数不可能的组合是( )
,则X、Y及该原子3d能级上的电子数不可能的组合是( )| A. | 18、8、0 | B. | 20、8、0 | C. | 25、13、5 | D. | 30、18、10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种溶液pH的大小顺序是③>②>④>① | |
| B. | 保持温度不变,将4种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 向4种溶液中分别加入25mL 0.1mol/L盐酸后,pH最大的是① | |
| D. | pH均为9时,4种溶液的物质的量浓度的大小顺序是②>③>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中pH>7,则溶液中:c(H2CO3)>c(CO32-) | |
| B. | 叠氮酸(HN3)与醋酸酸性相近,0.1 mol•L-1NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=4 | |
| B. | 2 min内B的反应速率为0.1 mol•(L•min)-1 | |
| C. | 混合气体密度不变,则表明该反应已达到平衡状态 | |
| D. | B的转化率为40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com