
分析 B可催化氧化为D,D可继续催化氧化为C,则B为醇,B、C中碳原子数目相同,可知A为CH3COOCH2CH3,B为CH3CH2OH,D为CH3CHO,C为CH3COOH,以此来解答.
解答 解:B可催化氧化为D,D可继续催化氧化为C,则B为醇,B、C中碳原子数目相同,可知A为CH3COOCH2CH3,B为CH3CH2OH,D为CH3CHO,C为CH3COOH,
(1)A与氢氧化钠溶液的反应为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH,
故答案为:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH;
(2)B催化氧化为D的反应为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)B在浓硫酸170℃加热条件下的反应为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(4)D与银氨溶液的反应为CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+2Ag↓+3NH3+H2O.
点评 本题考查有机物的推断,为高频考点,把握有机物的性质、反应、官能团的变化及B和C中具有相同碳原子为解答的关键,侧重分析与推断能力的考查,注意烃的含氧衍生物的性质,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 配制500mL 4.6mol/L的稀硫酸需取该硫酸125mL | |
| C. | 1mol Cu与足量的该硫酸反应产生2g氢气 | |
| D. | 等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
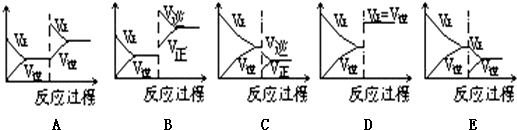
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
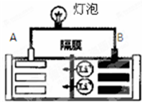 常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )
常见的一种锂离子电池的工作原理为LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6.电池工作时如图所示.下列说法不正确的是( )| A. | 该电池放电时A为负极 | |
| B. | 该电池放电时正极的电极反应式为:Li1-xCoO2+xLi+xe?═LiCoO2 | |
| C. | 该电池充电时阳极质量减轻 | |
| D. | 该电池充电时阴极的电极反应式为:6C+xLi++xe-═LixC6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去): .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com