
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.5×10-16 |


科目:高中化学 来源:不详 题型:计算题
 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
| A.Ksp(CuCO3)<Ksp(CaCO3) | B.c(Cu2+)<c(Ca2+) |
C.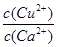 > > | D.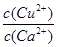 < < |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是| A.溶液中Ca2+离子数目减少 | B.溶液c(Ca2+)减小 |
| C.溶液的C(OH-)增大 | D.溶液中溶质的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 Ag2O2↓+2KNO3+K2SO4+2H2O
Ag2O2↓+2KNO3+K2SO4+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电离平衡常数受溶液浓度的影响 |
| B.电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的大 |
| C.电离平衡常数可以表示弱电解质的相对强弱 |
| D.H2CO3的电离常数表达式:K= |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
Ca2+(aq)+2OH-(aq)。下列说法正确的是( )| A.恒温下向溶液中加入CaO,溶液中Ca(OH)2的浓度增大 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,Ca2+浓度减小 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在一定温度下AgCl水溶液中Ag+和Cl—浓度的乘积是一个常数 |
| B.AgCl水溶液的导电性很弱,所以AgCl为弱电解质 |
| C.温度一定时,当AgCl水溶液中Ag+和Cl—浓度的乘积等于KSP值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入盐酸,c(Cl—)增大,KSP值变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | C.25°C时,Mg(OH)2固体在20ml0.01 mol·L-1氨水中的Ksp比在20mL0.01 mol·L-1NH4Cl溶液中的Ksp小 | D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com