
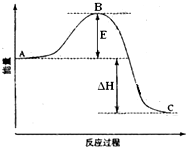
 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:分析 (1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)催化剂能够降低反应的活化能,不影响反应物和生成物能量高低;
(3)V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成V2O5;
解答 解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,大小对该反应的反应热无影响,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,催化剂能够降低反应的活化能,加V2O5会使图中B点降低,不影响反应物和生成物能量高低,反应焓变不变,
故答案为:表示反应物总能量、表示生成物总能量;无;降低;不变;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案为:-198.
(3)V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成V2O5,该催化循环机理的化学方程式为SO2+V2O5═SO3+2VO2、4VO2+O2═2V2O5,故答案为:SO2+V2O5═SO3+2VO2、4VO2+O2═2V2O5;
点评 本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
若NA表示阿伏伽德罗常数,下列说法正确的是
A.16g氧气和臭氧的混合物中含有的氧原子数为NA
B.标准状况下,22.4 L水中含有的原子数为NA
C.0.5mol/L的H2SO4溶液中含有硫酸分子数目为0.5NA
D.0.1mol氦气所含有的原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁件上镀银时,金属银作电解槽的阴极 | |
| B. | 用石墨电极电解硫酸溶液,其实质是电解水,故溶液PH值不变 | |
| C. | 电解法精炼铜时,电解一段时间后,电解液中C(Cu2+)将略有下降 | |
| D. | 为防止深埋地下的钢铁管道腐蚀,可将其与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 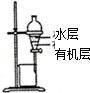 |
| A.装置可用于蒸干氯化铝溶液制AlCl3 | B.装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
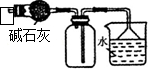 | 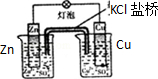 |
| C.装置可用于收集NH3或HCl气体,并防止倒吸 | D.装置盐桥中的K+自右向左移动 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取LKSCN溶液,向试管中滴入1~2滴0.1mol/LKSCN溶液 | (1)若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立. |
步骤2:另取2~3mL样品溶液于试管中滴入1~2mL品红稀溶液 | 1若品红溶液红色褪色,假设2成立; 2若品红溶液不褪色,结合步骤1中的(2)则假设3成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com