
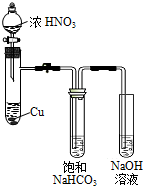
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:分析 (1)①碳酸氢钠溶液中碳酸氢根离子水解溶液显碱性;
②Cu与浓硝酸反应生成硝酸铜、红棕色气体二氧化氮和水,溶液娥呈蓝色;
③溶液中得到溶质晶体通过蒸发浓缩、冷却结晶、过滤洗涤得到;
(2)④二氧化氮与水反应生成硝酸;
⑤NO2与NaHCO3溶液反应生成NaNO2,此时氮的化合价降低,根据氧化还原反应的原理可知,还应有硝酸根生成;
⑥X中既有NaNO2又有NaNO3,在酸性条件下都能氧化碘离子;
⑦称取a gKMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液.移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定NaNO2溶液,原来NaNO2溶液无色,滴点终点时溶液由无色变为浅红色,消耗b mL KMnO4溶液,根据反应5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,利用高锰酸钾的物质的量可计算出X中所含有的NaNO2的物质的量,进而确定NaNO2的浓度;
解答 解:(1)①碳酸氢钠溶液中碳酸氢根离子水解沉淀大于电离程度,溶液显碱性,HCO3-+H2O?H2CO3+OH-,
故答案为:碳酸氢根离子水解沉淀大于电离程度,溶液显碱性,HCO3-+H2O?H2CO3+OH-;
②Cu与浓硝酸反应生成硝酸铜、红棕色气体二氧化氮和水,溶液娥呈蓝色,反应的方程式为;Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
故答案为:Cu逐渐减少(溶解)溶液变为蓝色,产生红棕色气体;
③欲从反应后的溶液中得到硝酸铜晶体,操作步骤是:蒸发浓缩、冷却结晶、过滤洗涤得到,故答案为:冷却结晶;
(2)④二氧化氮与水反应也能生成硝酸根,所以检验X中存在NO3-不能说明是NO2和NaHCO3溶液反应生成了硝酸根,
故答案为:二氧化氮与水反应也能生成硝酸根;
⑤NO2与NaHCO3溶液反应生成NaNO2,此时氮的化合价降低,根据氧化还原反应的原理可知,还应有硝酸根生成,所以NO2与NaHCO3溶液反应的化学方程式为2NO2+2NaHCO3═NaNO2+NaNO3+2CO2↑+H2O,反应的离子方程式为:2NO2+2HCO3-═NO2-+NO3-+2CO2↑+H2O,
故答案为:2NO2+2HCO3-═NO2-+NO3-+2CO2↑+H2O;
⑥X中既有NaNO2又有NaNO3,NaNO2和NaNO3在酸性条件下都能氧化碘离子生成碘单质,所以不能用KI淀粉溶液检验X中存在NaNO2,
故答案为:不能;NaNO2和NaNO3在酸性条件下都能氧化碘离子生成碘单质;
⑦称取a gKMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液.移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定NaNO2溶液,原来NaNO2溶液无色,滴点终点时溶液由无色变为浅红色,所以滴点终点的现象是滴入最后一滴KMnO4溶液时,溶液由无色变为浅红色且保持30s不褪色,消耗b mL KMnO4溶液,高锰酸钾的物质的量为 $\frac{ag}{158g/mol}$×$\frac{b}{250}$,
根据反应5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,
可知20.00mL X溶液中所含有的NaNO2的物质的量为$\frac{ag}{158g/mol}$×$\frac{b}{250}$×$\frac{5}{2}$=$\frac{ab}{15800}$mol,
所以NaNO2的浓度为=$\frac{\frac{ab}{15800}mol}{0.02L}$=$\frac{ab}{316}$mol/L,
故答案为:滴入最后一滴KMnO4溶液时,溶液由无色变为浅红色且保持30s不褪色;$\frac{ab}{316}$mol/L.
点评 本题考查较为综合,以物质的制备实验为载体,综合考查实验的设计、物质的检验、氧化还原滴定等知识,注意根据物质的性质设计实验方案,题目难度中等.


科目:高中化学 来源: 题型:解答题
 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
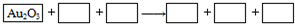
| A. | Na2S4O6、H2O、Na2S2O3、Au2O、NaOH | |
| B. | Na2S2O3、NaOH、Na2S4O6、Au2O、H2O | |
| C. | Na2S2O3、H2O、Na2S4O6、Au2O、NaOH | |
| D. | 当1 mol Au2O3完全反应时,转移电子8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素位于元素周期表的第三周期ⅦA | |
| B. | 该元素位于元素周期表的第二周期VA | |
| C. | 该元素的常见化合价有:-1、0、+1、+3、+5、+7等 | |
| D. | 该元素的氢化物的稳定性比PH3、H2S弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com