
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.所配的标准NaOH溶液物质的量浓度偏大
(2)判断滴定终点的现象是_____________________________________。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
【答案】① ABC 滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不恢复原色 22.60 0.2000
【解析】
本题考查酸碱中和滴定实验,中和滴定实验的步骤是
滴定前的准备:
滴定管:查漏→洗涤→润洗→装液→调液面→记录,锥形瓶:注液体→记体积→加指示剂
滴定:眼睛注视锥形瓶溶液颜色变化
终点判断:
数据处理:
(1)根据酸碱中和滴定的判断,步骤错误是①,没有用待盛液润洗;根据c待=c标×V标/V待
A、等质量的NaOH和KOH配制一定物质的量浓度的溶液,KOH的物质的量浓度小于NaOH的物质的量浓度,如果配制溶液中固体NaOH中混有KOH,标准溶液的物质的量浓度偏低,滴定时,消耗溶液的体积偏大, 故所测结果偏高,故A符合题意;
B、滴定管刻度从上到下增大,滴定终点时,仰视读数,所计算出消耗标准液的体积增大,即所测结果偏高,故B符合题意;
C、此操作得出消耗标准液的体积增大,所测结果偏高,故C符合题意;
D、NaOH浓度偏高,消耗标准液的体积减小,所测结果将偏低,故D不符合题意;
(2)滴定终点:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不恢复原色;
(3)根据图示,读数为22.60mL;
(4)三次消耗标准液的体积分别为20.00、22.10、20.00,第二次消耗的体积与其余相差太多,删去,两次平均消耗标准液的体积为20.00mL,c(HCl)=20.00×10-3×0.2000/(20.00×10-3)mol·L-1=0.2000mol·L-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是

A. “PX”的二氯代物共有6种(不考虑立体异构) B. “PX”的分子式为C8H10
C. “PX”分子中,最多有14个原子共面 D. 可用酸性KMnO4溶液鉴别“PX”与苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统,其工作原理是:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式N2(g)+3H2(g)![]() 2NH3(g)+92kJ,下列有关图像和叙述中正确的是
2NH3(g)+92kJ,下列有关图像和叙述中正确的是
A.  B.
B. 
C. 向密闭容器中通入1mol氮气和3mol氢气发生反应放出92kJ的热量D. 形成1mol氮氮键和3mol氢氢键所放出的能量比拆开6mol氮氢键所吸收的能量多92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL质量分数为20%,密度为1.2g/cm3的NaOH溶液吸收,恰好完全吸收,测得溶液中含有NaClO的物质的量为0.1mol。
(1)原NaOH溶液的物质的量浓度为___mol/L;
(2)所得溶液中Cl-的物质的量为___mol;
(3)原混合气体中氯气和氢气的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
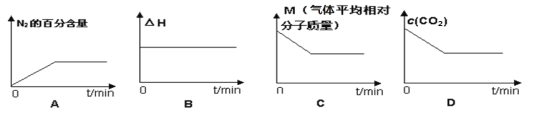
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L醋酸溶液中存在电离平衡CH3COOH ![]() CH3COO-+H+,要使溶液中c(H+)增大,可以采取的措施
CH3COO-+H+,要使溶液中c(H+)增大,可以采取的措施
A. 升高温度 B. 加少量烧碱溶液 C. 加CH3COONa固体 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是

A. 当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加
B. 断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C. 实验开始先断开K1,闭合K2,此时NO3-向B电极移动
D. 当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取一定质量的NaOH来测定未知浓度的盐酸时(NaOH放在锥形瓶内,盐酸放在滴定管中)。回答:
⑴准确称取一定质量的固体NaOH配成250 mL标准溶液。需要的仪器有天平、烧杯、量筒、玻璃棒、____________、____________(填仪器名称)。
⑵若选择酚酞作指示剂,滴定时左手控制酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______________________。到达滴定终点时的现象是:__________________________.
⑶下列各项操作可能会给实验结果造成误差,请用A.偏高;B.偏低;C.无影响填写(填序号)
①将NaOH溶液放入锥形瓶时,加入少量蒸馏水稀释 ______,
②酸式滴定管装入盐酸前未用该盐酸润洗 ______,
③滴定前读数时仰视,滴定完毕读数时俯视 ______,
④滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 _____,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com