
����������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±��dz����¼���������ʵĵ���ƽ�ⳣ����
���� | ���볣��(Ka��Kb) | �ѣ������� | �ܶȻ�������Ksp�� |
CH3COOH | 1��8��10��5 | BaSO4 | 1��10-10 |
HNO2 | 4��6��10��4 | BaCO3 | 2.6��10-9 |
HCN | 5��10��10 | CaSO4 | 7��10-5 |
HClO | 3��10��8 | CaCO3 | 5��10-9 |
NH3��H2O | 1��8��10��5 |
��ش��������⣺
��1�������������У�������������_____________ (�û�ѧʽ��ʾ)��������ʹ������Һ��CH3COOH�ĵ���̶��������볣������IJ�����________________(�����)��
A�������¶� B����ˮϡ��
C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ��________ (ѡ����ԡ������ԡ����ԡ�)��������__________________����Һ�и�����Ũ�ȴ�С�Ĺ�ϵ��_____________________��
��3�����ʵ���1��1��NaCN��HCN�Ļ����Һ����pH��7������Һ�����ӵ�Ũ�ȴӴ�С����Ϊ_____________________________________��
��4����ҵ�г���BaSO4ת��ΪBaCO3���ٽ����Ƴɸ��ֿ����Եı��Σ��磺BaCl2���������������ñ��͵Ĵ�����Һ����BaSO4��ĩ�������ϲ��䴿����BaSO4ת��ΪBaCO3������������BaSO4����Һ���ڸ�����Һ�мӴ����ĩ�����Ͻ��裬ΪʹSO42-���ʵ���Ũ�ȴﵽ0.0lmol��L-1���ϣ�����Һ��CO32-���ʵ���Ũ��Ӧ ��____________mol��L-1��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡʯ��ׯ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾװ�ÿ�������ȡFe(OH)2�۲�Fe(OH)2�ڿ����б�����ʱ����ɫ�仯��ʵ���ṩ���Լ�����м��6 mol/L������Һ��NaOH��Һ������˵���������
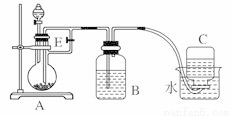
A. B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ�����Լ�����м
B. ʵ�鿪ʼʱӦ�Ƚ�����E�ر�
C. ����Fe(OH)2�IJ���Ϊ���ر�E��ʹA����Һѹ��Bƿ��
D. ȡ��װ��B�е���Ƥ����ʹ�������룬�йط�Ӧ�Ļ�ѧ����ʽΪ��4Fe(OH)2+O2+2H2O��4Fe(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�˲��и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������ʳ�û����ͻ���ˮ�ݣ��㽫�������к��ַ������루 )
A. ���� B. ���� C. ��Һ D. ��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ�����а�У������ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ���������ǣ�������
A. 0.1mol•L��1CH3COONa��Һ��H+��Al3+��Cl����NO3��
B. ����NaNO3����Һ��H+��Fe2+��SO42����Cl��
C. ��ʹ���ȱ�����Һ��K+��Na+��NO3����Cl��
D. ��ˮ���������c��H+��=10��12 mol•L��1����Һ��NH4+��SO42����HCO3����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��㶫ʡ�߶���ѧ����ĩ���Ի�ѧ�������Ծ��������棩 ���ͣ������
���������������߷��ļ��ڣ���������β����ȼúβ�������������ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)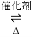 2CO2(g)+N2(g)
2CO2(g)+N2(g)
����һ�������£���һ���ݻ��̶�Ϊ2L���ܱ������г���0.8molNO��1.20molCO����ʼ��Ӧ��3minʱ���CO��ת����Ϊ20%������N2��ʾ��ƽ����Ӧ����ΪV(N2)=__________��
�ڶ������෴Ӧ����ij��֣�B����ƽ��ѹǿ��PB���������ʵ���Ũ�ȣ�CB��Ҳ���Ա�ʾƽ�ⳣ��������Kp������÷�Ӧƽ�ⳣ���ı���ʽKp=______________��
�۸÷�Ӧ�ڵ��������Է����У��÷�Ӧ�ġ�H_______0����ѡ�>������=����<����
����ijһ���ȣ����ݵ��ܱ������г���һ������NO��CO����������Ӧ���������Ӧ��������ʱ��仯��������ͼ��ʾ����֪t2��t1=t3��t2����������˵������ȷ����__________�������ţ�
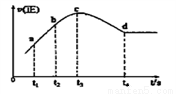
A����Ӧ��c��δ�ﵽƽ��״̬ B����Ӧ����a��С��b��
C����Ӧ��Ũ��a�����b�� D��NO��ת����t1��t2=t2��t3
��2��ʹ�ü״����Ϳ��ܼ�������β���Ի�������Ⱦ��ij��������ˮú��Ϊԭ�Ϻϳɼ״������������£�������ɱ���ܱ������з�����Ӧ��CO��g��+2H2��g��?CH3OH��g��������ƽ��ʱ�����CO��H2��CH3OH�ֱ�Ϊ1mol��1mol��1mol�����������Ϊ3L�����������м���ͨ��3mol CO����ʱv������____v���棩��ѡ�������������������=�������жϵ�����____________��
��3��������Ҳ�������Դ���úϳ����ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��
2CO(g)+4H2(g)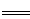 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
��֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�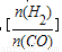 �ı仯������ͼ��
�ı仯������ͼ��
��a��b��c���Ӵ�С��˳������Ϊ___________��
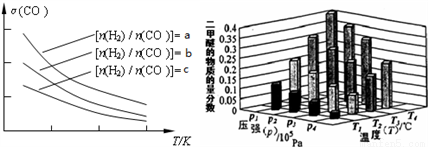
��ij�¶��£���2.0mol CO��g����4.0mol H2��g�������ݻ�Ϊ2L���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3��g�������ʵ��������仯�������ͼ��ʾ�������¶Ⱥ�ѹǿ�Ĺ�ϵ�ж���ȷ����___________��
A��P3��P2��T3��T2 B��P1��P3��T1��T3
C��P2��P4��T4��T2 D��P1��P4��T2��T3
���ں����ܱ������ﰴ�����Ϊ1��2����һ����̼��������һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ�����淴Ӧ�����ƶ�����___________��
A������Ӧ������������С
B���淴Ӧ������������С
C����ѧƽ�ⳣ��Kֵ����
D����Ӧ�������ٷֺ�������
E�����������ܶȼ�С
F��������ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶���ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ö��Ե缫���һ��Ũ�ȵ�����ͭ��Һ��ͨ��һ��ʱ��������õ���Һ�м���0.1molCu2(OH)2CO3��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH(������CO2���ܽ�)����������й�ת�Ƶ��ӵ����ʵ���Ϊ( )
A. 0.4mol B. 0.5mol C. 0.6mol D. 0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶���ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��Ӧ A + 3B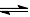 2C + D ��ij��ʱ������A��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ1mol/(L��min)����˶�ʱ������BŨ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ( )
2C + D ��ij��ʱ������A��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ1mol/(L��min)����˶�ʱ������BŨ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ( )
A. 0.5 mol/(L��min) B. 1 mol/(L��min)
C. 2 mol/(L��min) D. 3 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�˲��и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶��£���ӦN2O4(g)  2NO2(g)����H>0�����ܱ������дﵽƽ��.����˵������ȷ����
2NO2(g)����H>0�����ܱ������дﵽƽ��.����˵������ȷ����
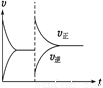
A. ��ѹʱ(�����С)��ƽ�����淴Ӧ�����ƶ�����ʹ����Ӧ��������
B. ijʱ�̸ı���������ʱ������ͼ���ı�������Ǻ���ʱ����N2O4��Ũ��
C. ����������䣬��������N2O4��ƽ��������Ӧ�����ƶ����ٴ�ƽ��ʱ��ɫ����
D. ����ѹǿ���䣬��������N2O4�������������ƽ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��ˮ�и߶���ѧ�ڿ�ѧ���ԣ�������ҵ��⣩��ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������ԭ�����͵���
�ٴ�ѩ�̵�ƿ�ǣ������������ݳ�
����H2��I2��HI����������ɵ�ƽ����ϵ��ѹ����ɫ����
�ۿ���Ũ��ˮ���������ƹ������������ư�
�����շ����������������SO2����
��ʹ������ý��ʹN2��H2�Ļ�����������ںϳ�NH3
����������еİ���Һ�������ںϳɰ���Ӧ
��500�����ұ����¸������ںϳ�NH3
������FeCl2��Һʱ����������м
��ʵ���ҳ����ű��ͺ�ʳ��ˮ���ռ�Cl2
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com