
| A. |  | B. |  | C. |  | D. | 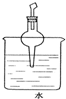 |
分析 HCl是极性分子,水是极性分子,四氯化碳是非极性分子,则HCl极易溶于水,难溶于四氯化碳,吸收HCl时不能直接将导管插入水中,必须使用防止倒吸的装置;常用的方法为:使用倒置的漏斗、使用球形干燥管、使用四氯化碳和水的混合液,据此进行判断.
解答 解:HCl是极性分子,水是极性分子,四氯化碳是非极性分子,氯化氢易溶于水,难溶于四氯化碳.
A.倒置的漏斗可防倒吸,故A错误;
B.氯化氢难溶于四氯化碳,可防倒吸,故B错误;
C.氯化氢易溶于水,会发生倒吸,故C正确;
D.球形干燥管能防止倒吸,故D错误;
故选:C.
点评 本题考查尾气处理装置,注意根据“相似相溶”规律解题,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 16 g O2和O3的混合气体中,所含氧原子数为0.5NA | |
| C. | 5.6 g 铁在足量氯气中燃烧,转移电子数为0.2 NA | |
| D. | 9g D2O所含的中子数为4.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯能使酸性高锰酸钾溶液褪色 | |
| B. | 苯分子具有平面正六边形结构,12个原子在同一平面上,对位上的4个原子在一条直线上 | |
| C. | 苯能使溴水褪色,是发生了取代反应 | |
| D. | 苯不含有碳碳双键故不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
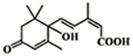 大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )| A. | 1mol该物质与足量的NaOH溶液反应最多消耗2mol NaOH | |
| B. | 该物质在Cu作催化剂条件下能被催化氧化 | |
| C. | 该物质能发生氧化、还原、取代反应 | |
| D. | 分别与足量的Na、NaHCO3 反应生成的气体在相同状况下体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)=c(NH3•H2O) | |
| D. | 向③、④中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
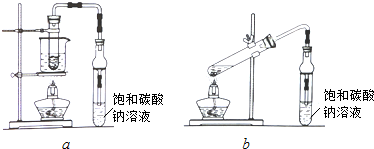
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com