
【题目】有机物所含的官能团种类和结构会决定有机物的性质。
(1)多巴胺是一种神经传导物质,可影响人的情绪,其结构简式如图所示。

①多巴胺分子中官能团的名称为_____(填两种)。
②1 mol多巴胺最多可以消耗_____mol溴水中的Br2。
③多巴胺分子通常需要密封保存,其原因是_____。
(2)化合物D是合成一种心脏病药物的中间体,合成它的路线如下:
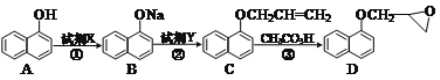
①A分子中含_____种化学环境不同的氢。试剂X的化学式可以是_____。化合物D中含氧官能团的名称为_____。
②试剂Y的分子式为C3H5Cl,其结构简式为_____。
③化合物E是A的一种同分异构体,其分子中含有苯环,能发生银镜反应,能与溴水发生加成反应,分子中有4种不同化学环境的氢原子。任写一种符合条件的化合物E的结构简式:_____。
【答案】羟基、氨基 3 易被氧气氧化 8 NaOH或Na2CO3或Na 醚键 CH2=CHCH2Cl ![]() 或
或![]()
【解析】
有机物所含的官能团种类和结构会决定有机物的性质。
⑴多巴胺是一种神经传导物质,可影响人的情绪,其结构简式如图所示。

①多巴胺分子中官能团的名称为羟基、氨基,故答案为羟基、氨基。
②酚羟基的邻位和对位易与溴水发生取代反应, ,即多巴胺最多可以消耗3 mol溴水中的Br2,故答案为3;
,即多巴胺最多可以消耗3 mol溴水中的Br2,故答案为3;
③多巴胺分子由于含有酚羟基,易被氧化,故答案为易被氧气氧化;
⑵化合物D是合成一种心脏病药物的中间体,合成它的路线如下:

①A分子无对称性,故每个氢原子就是一种化学环境的氢,即含8种化学环境不同的氢。从A到B可知—OH变为—ONa,可知加钠、氢氧化钠、碳酸钠都可以生成B,化合物D中含氧官能团的名称为醚键,故答案为8;NaOH或Na2CO3或Na;醚键;
②试剂Y的分子式为C3H5Cl,根据C的结构可以知B到C发生取代反应,因此C的结构简式为CH2=CHCH2Cl;故答案为CH2=CHCH2Cl;
③化合物E是A的一种同分异构体,其分子中含有苯环,![]()
能发生银镜反应,说明含—CHO,
能与溴水发生加成反应,说明函碳碳双键或者碳碳三键,一个碳不能同时连两个碳碳双键
分子中有4种不同化学环境的氢原子。其同分异构的结构简式:![]() 或
或![]() 故答案为
故答案为![]() 或
或![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有下列各组物质:
①红磷、白磷 ②![]() 、
、![]() ③
③![]() 、
、![]() ④
④![]() 、
、![]() ⑤
⑤![]() 、
、![]() ⑥
⑥![]() 、
、![]()
其中属于同位素的是______________,属于同素异形体的是___________,属于同种元素的不同种微粒的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:A________、B________、C________、D________。
(2)写出A元素原子的核外电子排布式:____________;写出B元素原子核外电子排布的价电子构型:__________;用电子排布图表示C原子的核外电子排布情况:_______________。
(3)比较四种元素的第一电离能和电负性的大小:第一电离能____________;电负性____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是
A.用图甲装置可以测量乙醇与钠反应后生成氢气的体积
B.用图乙装置可以验证氯气与水反应有盐酸生成
C.用图丙装置可以比较苏打和小苏打的热稳定性 
D.用图丁装置可以验证溴乙烷与NaOH醇溶液共热产生了乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示的离子晶体空间结构示意图。

(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式:A________,B________,C_________,D________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的空间结构。
①FeS2晶体中存在的化学键类型是 ________。
②若晶体结构A中相邻的阴、阳离子的最小距离为a cm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学–选修3:物质结构与性质)碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是_____________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:________________。

(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Gr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式__________;CH3COOH分子中碳原子的杂化类型为___________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
③铜铬合金的晶胞如图所示,已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在一定条件下发生反应:A+B=C+D,14gA和9gB恰好完全反应生成0.5molC和1gD则物质C的摩尔质量为____________;
(2)某1L混合溶液中所含离子的个数比如下表,则M离子可能为(_______)
所含离子 | NO3- | SO42- | Cu2+ | M |
个数比 | 4 | 1 | 2 | 1 |
A.Ba2+ B.Mg2+ C.Cl- D.Na+
(3)已知a g气体X2中含有b个X原子,那么c g该气体在标准状况下的体积是____________;
(4)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使SO![]() 完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。
完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com