(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K
3[Fe(C
2O
4)
3]?nH
2O,常作为有机反应的催化剂.实验室可用(NH
4)
2Fe(SO
4)
2?2H
2O等为原料制备,实验步骤如下:
步骤1:称取2.5g (NH
4)
2Fe(SO
4)
2?2H
2O放入烧杯中,滴入3滴硫酸后再加水溶解.
步骤2:向上述溶液中加入饱和草酸溶液12.5mL,沸水浴加热,使形成FeC
2O
4?2H
2O黄色沉淀.
步骤3:沉淀经洗涤、除杂后,加入5mL饱和K
2C
2O
4溶液,滴加6% H
2O
2溶液5mL,再加入饱和草酸溶液4mL.
步骤4:冷却至室温,加入10mL 95%乙醇和几粒硝酸钾,置于暗处1~2h即可析出三草酸合铁(Ⅲ)酸钾晶体.
(1)步骤1中加入少量硫酸的目的是
防止Fe2+水解
防止Fe2+水解
.步骤3中滴加H
2O
2溶液的目的是
使Fe2+氧化为Fe3+
使Fe2+氧化为Fe3+
.
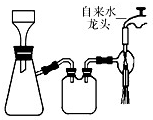
(2)步骤4中将析出的晶体通过如图所示装置进行减压过滤.下列操作不正确的是
BC
BC
(填字母).
A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸
(3)晶体中所含的结晶水可通过重量分析法测定,主要步骤有:①称量;②置于烘箱中脱结晶水;③冷却;④称量;⑤重复步骤②~④至恒重;⑥计算.步骤③需要在干燥器中进行,理由是
防止吸收空气中的水
防止吸收空气中的水
;步骤⑤的目的是
检验晶体中的结晶水是否已全部失去
检验晶体中的结晶水是否已全部失去
.
(4)晶体中C
2含量的测定可用酸性KMnO
4标准溶液滴定.滴定过程中发现,开始时滴入1滴KMnO
4溶液,紫红色褪去很慢,滴入一定量后紫红色很快褪去,原因是
生成的Mn2+起催化作用
生成的Mn2+起催化作用
.



 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下: