
| A. | ②③ | B. | ③④ | C. | ①③ | D. | ①④ |
分析 ①由甲苯制甲基环己烷为加成反应、由乙烷制溴乙烷为取代反应;
②乙烯使溴水褪色为加成反应、乙炔使酸性高锰酸钾溶液褪色为氧化反应;
③由乙烯制聚乙烯为加聚反应、由丁二烯制聚-1,3-丁二烯为加聚反应;
④由苯制硝基苯为取代反应、由苯制溴苯为取代反应.
解答 解:①由甲苯制甲基环己烷为加成反应、由乙烷制溴乙烷为取代反应,反应类型不同,故不选;
②乙烯使溴水褪色为加成反应、乙炔使酸性高锰酸钾溶液褪色为氧化反应,反应类型不同,故不选;
③由乙烯制聚乙烯为加聚反应、由丁二烯制聚-1,3-丁二烯为加聚反应,反应类型相同,故选;
④由苯制硝基苯为取代反应、由苯制溴苯为取代反应,反应类型相同,故选;
故选B.
点评 本题考查有机物的结构与性质,为高考高频考点,把握官能团与性质、有机反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②过程中都只发生了物理变化 | |
| B. | 石油主要是由各种烷烃、环烷烃、芳香烃组成的混合物 | |
| C. | 石油的分馏产品中不能得到汽油、柴油 | |
| D. | ③是加成反应,产物名称是1,2-溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molS2C12价电子数为66NA | |
| B. | 氧化产物与还原产物的物质的量之比为l:7 | |
| C. | 每生成l mol SO2转移4 NA电子 | |
| D. | 每生成48g硫单质会断裂5NA共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
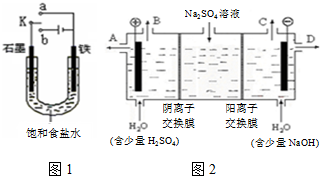
 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的正极和电解池的阳极所发生的反应 | |
| B. | 原电池的阳极和电解池的负极所发生的反应 | |
| C. | 原电池的负极和电解池的阳极所发生的反应 | |
| D. | 原电池的负极和电解池的阴极所发生的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com