
| A. | 空气 | B. | 漂白粉 | C. | 氧化铝 | D. | 镁铝合金 |
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:解答题
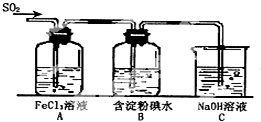 某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
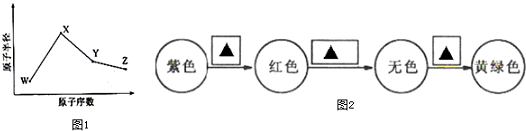
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 0.50mol/L H2SO4溶液与50mL 0.50mol/L Ba(OH)2溶液 | |
| B. | 50mL 0.50mol/L盐酸溶液与50mL 0.50mol/L NaOH溶液 | |
| C. | 50mL 0.50mol/LCH3COOH溶液与50mL 0.50mol/L NaOH溶液 | |
| D. | 50mL 0.50mol/L盐酸溶液与50mL 0.50mol/L氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a极是负极,b极是正极 | |
| B. | 负极的电极反应式为CH2═CH2+H2O+2e-═CH3CHO+2OH- | |
| C. | 当有0.1molO2反应时,会有0.4molH+迁移 | |
| D. | 电子移动方向:电极a→负载→电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com