
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
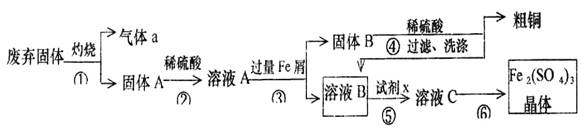
(1)除酒精灯和铁架台或三脚架外,①中所需的容器名称为 ;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为 ;
(3)写出步骤③发生反应的离子方程式 ;
(4)步骤⑥的实验操作为 、过滤、烘干。
(5)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的
SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol/L硫酸、1.0 mol/LNaOH溶液、0.1 mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象
。
科目:高中化学 来源: 题型:
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
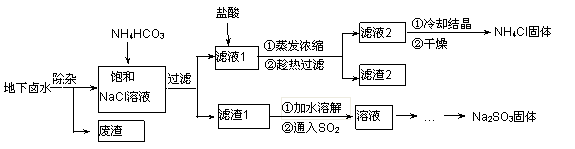
已知以下四种物质的溶解度曲线图:

(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
物质 | 电离常数(25℃) |
H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
(4)已知H2CO3和H2SO3的电离常数如下表,
“通入SO2”反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O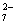 转
转
化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究
有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始pH | 废水样品体积mL | 草酸溶液体积mL |
|
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
测得实验①和②溶液中的Cr2O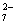 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明  ;实验①中0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
;实验①中0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
(用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二: ;
假设三: ;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、Al2Fe(SO4)4·24H2O、Al2(SO4)3等,溶液中Cr2O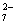 的浓度可用仪器测定。)
的浓度可用仪器测定。)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是( )
A.若无固体剩余,则溶液中一定有Fe3+ B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出 D.若溶液中有Fe2+,则一定有Cu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 胆矾 | 石灰水 | 硫酸钡 | Al(OH)3 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 碘化氢 | 乙醇 |
A. A B. B C. C D. .D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能到达实验目的地( )
|
| A. |
除去Cl2中含有的少量HCl |
|
| B. |
蒸干FeCl3饱和溶液制备FeCl3晶体 |
|
| C. |
制取少量纯净的CO2气体 |
|
| D. |
分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
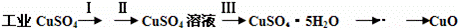
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(1)步骤Ⅰ的目的是除不溶性杂质.所需操作的名称是 溶解、过滤 .
(2)步骤Ⅱ的目的是除硫酸亚铁.操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.
①写出用H2O2溶液除去硫酸亚铁的离子方程式 .
②调整pH 的范围应该在 之间.
(3)步骤Ⅲ的目的是得到CuSO4•5H2O晶体.操作是将溶液加热蒸发至有晶膜出现时,停止加热, ,水浴加热烘干.采用水浴加热的原因是 .
(4)该同学用CuSO4溶液进行如下探究实验:
取A、B两支试管,分别加入 2mL 5% H2O2溶液,再向H2O2溶液中分别滴入0.1mol•L﹣1FeCl3和CuSO4 溶液各1mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确 (填正确或错误),请说明原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
肼是重要的化工原料。某探究小组利用下
列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一: 制备NaClO溶液。(实验装置如右图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。

(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓
度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实验方案。
。
实验二: 制取水合肼。(实验装置如右图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。
加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com