
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
|
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
|
| B. | NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
|
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
|
| D. | 氨气分子是极性分子而甲烷是非极性分子 |
考点:
原子轨道杂化方式及杂化类型判断.
专题:
化学键与晶体结构.
分析:
NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,为正四面体构型.
解答:
解:NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N﹣H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C﹣H之间的键角相等为109°28′,故CH4为正四面体构型,故ABD错误,C正确.
故选:C.
点评:
考查了分子空间构型的判断,难度中等,注意理解价层电子对互斥理论与杂化轨道理论.


科目:高中化学 来源: 题型:
下列有关说法中错误的是()
A. CCl4可以由CH4制得,它可用于萃取碘水中的碘
B. 相等的物质的量的乙烯和甲烷完全燃烧后产生的水的质量相同
C. 用乙烯与HCl反应来制备氯乙烷比用乙烷与氯气反应更好
D. 甲烷不能使酸性高锰酸钾溶液褪色,因此甲烷不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,能用H++OH﹣═H2O表示的是()
A. NaOH溶液和CO2的反应 B. Ba(OH)2溶液和稀H2SO4的反应
C. NaOH溶液和盐酸的反应 D. 氨水和稀H2SO4的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
|
| A. | 3s23p3 | B. | 4s2 | C. | 4s24p1 | D. | 3s23p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知( )
|
| A. | X的原子半径大于Y的原子半径 |
|
| B. | X的电负性大于Y的电负性 |
|
| C. | X阴离子的半径小于Y阳离子的半径 |
|
| D. | X的第一电离能小于Y的第一电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是学习和研究化学的重要工具.表是元素周期表的一部分,A﹣F代表六种不同短周期元素.下列说法不正确的是( )
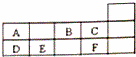
|
| A. | 原子序数E<C | B. | A、D同族 |
|
| C. | A、B同周期 | D. | C、F化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是元素周期表的一部分.原子序数为10的元素名称为 ;氟原子的核外电子数为 ,等质量的氧气和氟气中,所含原子数较少的是 .
| 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物.下列关于MMF的说法不正确的是()
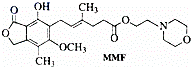
A. MMF不能溶于水
B. MMF能发生取代反应和消去反应
C. 1molMMF能与4mol氢气发生加成反应
D. 1molMMF能与含3molNaOH溶液完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com