
![]() ,当
,当![]() 与CH3CH2OH发生酯化反应时,不可能生成的是( )
与CH3CH2OH发生酯化反应时,不可能生成的是( )
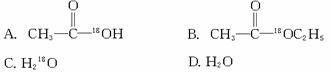
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:江苏省扬州中学2012届高三最后冲刺热身化学试题 题型:058
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2.K2FeO4在处理水的过程中所起的作用有________.
4Fe(OH)3+8OH-+3O2.K2FeO4在处理水的过程中所起的作用有________.
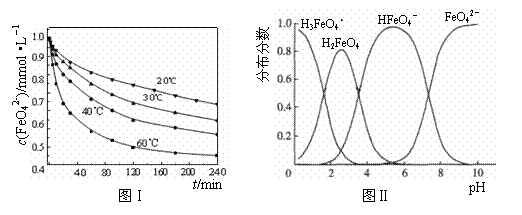
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.该实验的目的是________;发生反应的ΔH________0(填“>”、“<”或“=”).

(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是________(填字母).

A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-![]() FeO42-+H2O
FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1 mL.滴定时发生的反应为:Fe2++Cr2O72-+H+![]() Fe3++Cr3++H2O(未配平)
Fe3++Cr3++H2O(未配平)
①写出步骤2中发生反应的离子方程式________.
②根据上述实验数据,测定该溶液中K2FeO4的浓度为________mol·L-1(用含字母的代数式表示).
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
 4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有_______________________ 。
4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有_______________________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
在NH4Cl水溶液中用空气氧化碳酸钴(II)可以得到具有光泽的红色氯化物A(NH3:Co:Cl为4:1:1)。将A的固体在0℃下加入用HCl气体饱和的无水乙醇中,在室温下有气体迅速释放,将其振摇至不再有气体发生,得到蓝灰色固体B,B是一种混合物。将B过滤,用乙醇洗涤,然后用少量冷水洗涤, 所得主要产物再经一系列提纯步骤产生紫色晶体C (化学式: CoCl3?4NH3?0.5H2O)。当C在浓盐酸中加热时, 可以分离出一种绿色化合物D, 经分析为CoCl3?4NH3?HCl?H2O。D可溶于冷水,加浓盐酸就沉淀出来。
提示:
① 已知[CoCl2(en)2]+可被拆分的异构体形式是紫色的;并且在溶液中存在如下平衡:
紫色-[CoCl2(en)2]Cl ![]() 绿色-[CoCl2(en)2]Cl?HCl?2H2O
绿色-[CoCl2(en)2]Cl?HCl?2H2O
注:en = H2NCH2CH2NH2
② 在-12℃的低温下,用HCl气体饱和了的盐酸处理如下图所示的双核配合物![]() ,同样能得到C。
,同样能得到C。
回答下列问题:
(1) A~D分别代表何种化合物?请分别画出C与D中配离子的立体结构。
(2) 写出并配平所有的化学方程式。
(3) 试根据C与D中配离子的立体结构判断它们的极性,并简要说明理由。
(4) 用少量冷水洗涤B目的何在?浓盐酸在绿色化合物D形成中起什么作用?
(5) C与D之间的转化属于一种什么类型的反应?
(6) 由题给条件和提示说明你所推测的化学反应发生的依据。查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
 |
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点,消耗(NH4)2Fe(SO4) 2溶液V1 mL。滴定时发生的反应为:Fe2++Cr2O72-+H+→Fe3++Cr3++H2O(未配平)
①写出步骤2中发生反应的离子方程式 。
② 根据上述实验数据,测定该溶液中K2FeO4的浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
 |
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点,消耗(NH4)2Fe(SO4) 2溶液V1 mL。滴定时发生的反应为:Fe2++Cr2O72-+H+→Fe3++Cr3++H2O(未配平)
① 写出步骤2中发生反应的离子方程式 。
② 根据上述实验数据,测定该溶液中K2FeO4的浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com