
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是( )
A.HX、HY两种弱酸的酸性:HX>HY
B.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
C.结合H+的能力:CO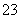 >Y->X->HCO
>Y->X->HCO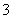
D.HX和HY酸性相同,都比H2CO3弱
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
若室温下0.1mol·L-1NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( )
A.0.01% B. 0.09%
C.1.0% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.25 ℃时,pH=13的氨水中含有OH-的数目为0.1 NA
B.标准状况下,2.24 L NO2与水反应生成NO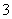 的数目为0.1 NA
的数目为0.1 NA
C.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D.4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
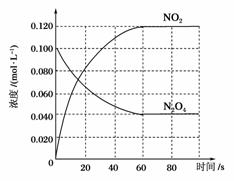
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深 。
。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为__________mol·L-1·s-1,反应的平衡常数K1为______________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是______________________________。
②列式计算温度T时反应的平衡常数K2______________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由______________________________________________________ ___________ _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)
ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
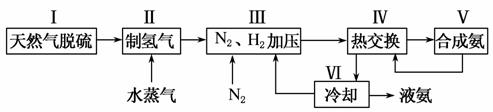
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式_____________________________________________________ _____________________________________________________________________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________(填选项字母)。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为______________________ __________________________________________________。
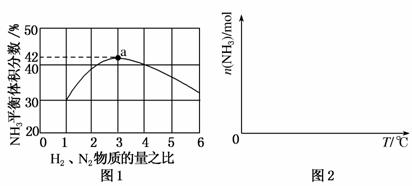
(3)图1表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数为________。
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在T ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。
又知T ℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )
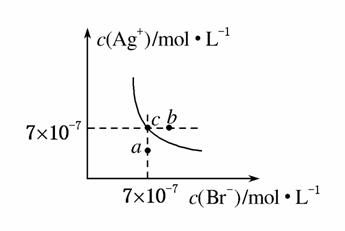
A.在T ℃时,AgBr的Ksp为4.9×10-13
B.图中b点对应的是向AgBr饱和溶液中加入NaBr固体后的溶液
C.图中a点对应的是AgBr的不饱和溶液
D.AgCl沉淀能较容易转化为AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的描述和该性质的应用均正确的是( )
A.FeCl3具有氧化性,用FeCl3溶液刻蚀印刷电路板
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.过氧化钠只有 氧化性,用过氧化钠为潜水艇舱提供氧气
氧化性,用过氧化钠为潜水艇舱提供氧气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+ O2(g)= 2NO(g) △H= + 180.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(g) △H= - 483.6 kJ/mol
则反应2H2(g)+ 2NO(g) = 2H2O(g) + N2(g) △H=________。
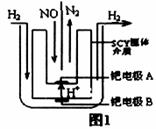 (2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(3)污染物NO、NO2也可以用烧碱溶液吸收,生成物中无气体,该反应的离子方程式为______________________________________________。只有NO2也能与NaOH溶液反应,生成NaNO2 和NaNO3 。现用某烧碱溶液完全吸收n mol NO2和m mol NO组成的混合气体,若所得溶液中c(NO3-): c(NO2-) = 1:9,则原混合气体中NO2和NO的物质的量之比n:m =_______________ 。
(4)下列有关含氮元素溶液的说法正确的是______________
A.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,
c[(NH4)2Fe(SO4)2] > c[(NH4)2SO4]>c[(NH4)2CO3]
B.常温下,等体积的pH=13的NaOH溶液和pH=1的HNO2溶液混合,所得溶液中
c(Na+)>c(NO2—)>c(OH—)>c(H+)
C.某溶液中只存在OH—、H+、Cl—、NH4+四种离子,其离子浓度c(NH4+)>c(Cl—)>c(OH—)>c(H+),则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—)
D.将NH4Cl溶液蒸干制备NH4Cl固体
E.施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
F.反应NH3(g)+HCl(g)=== NH4Cl(s)在室温下可自发进行,则该反应的△H<0
(5) NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性、原因是
(用离子方程式表示)。向该溶液滴加氨水至溶液b L时呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所得溶液中氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
(6)在恒容密闭容器中,氨基甲酸铵(NH2COONH4)分解反应:
NH2COONH4(s)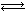 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
① 可以判断该分解反应已经达到平衡的是 。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
② 取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是 (填“增大”,“减小”或“不变”),平衡常数_________(填“增大”,“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙与醋酸:CaCO3+2H+=Ca2++ CO2↑+H2O
C. 盐酸与氢氧化钡溶液:H++OH-=H2O
D.铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com