
【题目】海水晒盐得到的粗盐中还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是实验室制备精盐的实验方案:

(1)除去泥沙和沉淀选用图中___装置,B装置的操作名称是___,在上述方案中图中装置中不会用到的是___。
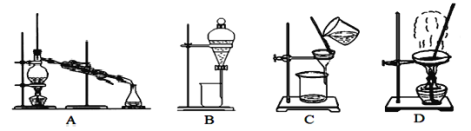
(2)第⑦步操作的名称是___,所用到的实验装置是图中的___(填字母);
(3)为除去粗盐中的可溶性杂质,通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入BaCl2试剂的目的是___,三种试剂加入的合理顺序是___。
【答案】C 分液 A、B 蒸发结晶 D 除去Na2SO4(或除去SO42-) cba(bca)
【解析】
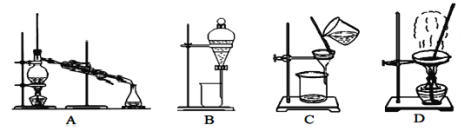
A装置为蒸馏装置,用于分离沸点相差较大的液体混合物;B装置为分液装置,用于分离不互溶的液体混合物;C装置为过滤装置,用于分离混有固、液混合物;D装置为蒸发装置,用于从溶液中提取溶质溶液。
从实验流程图看,各步操作的目的是:①溶解粗盐,②、③、④除去粗盐中的CaCl2、MgCl2、Na2SO4杂质,⑤去除盐水中的难溶性杂质,⑥除去食盐水中的Na2CO3和NaOH杂质,⑦提取精盐水中的NaCl。
(1)从粗盐水中去除泥沙和沉淀,属于固、液混合物的分离,选用图中C装置。答案为C;
B装置的操作名称是分液。答案为分液;
在上述方案中,不会用到的是图中的蒸馏装置和分液装置。答案为A、B;
(2)第⑦步操作的目的是提取精盐水中的NaCl,所以操作名称是蒸发结晶。答案为蒸发结晶
所用到的实验装置是图中的D。答案为D;
(3)为除去粗盐中的可溶性杂质,通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入BaCl2试剂的目的是除去Na2SO4(或除去SO42-)。
答案为:除去Na2SO4(或除去SO42-);
因为加入的除杂试剂都是过量的,过量的除杂试剂也将成为杂质,需要去除。BaCl2过量时,只能用Na2CO3除去,所以Na2CO3一定要在BaCl2之后加入。因此三种试剂加入的合理顺序是cba(bca)。答案为cba(bca)。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是

A. 该混合气体中一定含有乙烯
B. 该混合气体一定含有甲烷和乙炔
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的资源,多种多样的海洋动物、植物、矿藏等。如图是从海水中提取某些物质的示意图。已知:海水中含量最高的几种离子的浓度依次为
微粒种类 | Cl- | Na+ | Mg2+ |
| Ca2+ |
微粒浓度 | 0.55mol·L-1 | 0.47mol·L-1 | 0.054mol·L-1 | 0.027mol·L-1 | 0.01mol·L-1 |
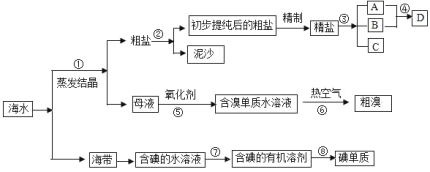
请根据以上信息回答下列问题:
(1)写出步骤②的操作名称_______;实验室中步骤⑤所需的玻璃仪器除烧杯外,还需要的仪器是___________。
(2)D具有杀菌消毒的作用,请写出反应④的离子方程式___________。
(3)初步提纯后的粗盐中含有等Ca2+、Mg2+、![]() 等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
a.加适量盐酸;b.加稍过量的氯化钡溶液,再加稍过量的NaOH溶液;c.过滤;d.蒸发结晶;e.加稍过量碳酸钠溶液
(4)____________(填“能”或“不能”)用![]() 一种试剂替代步骤②中两种试剂,理由是________。
一种试剂替代步骤②中两种试剂,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水。下列说法不正确是
A.步骤①,硫酸酸溶后溶液中主要有Fe3+、Fe2+等阳离子
B.步骤②的反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,消耗1molFeS2转移16mol电子
C.步骤③,得到的绿矾晶体久置于空气中会变质
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ·mol-1。它可以作为燃料电池的燃料。
(1)写出甲烷燃烧的热化学方程式:________;
(2)已知H2(g)和C(S)的燃烧热分别是285.8kJ·mol-1、393.5kJ·mol-1;则反应C(S)+ 2H2(g)=CH4(g)的反应热⊿H=______________;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为:___________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
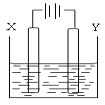
①请写出电解过程中阴极附近观察到的现象:___________________。
②到燃料电池消耗2.8LO2(标准状况下)时,计算此时NaCl溶液的pH=____(假设溶液的体积不变,气体全部从溶液中逸出)。
在Y极通过的电子的物质的量为:______________。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质_____(填名称),溶液中Cl―流向___极(填“X”或“Y”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移6mol电子
C. AlN属于离子化合物,其中氮元素的化合价为+3
D. AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用 过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度_______________;
(2)产生的气体在标准状况下的体积_____________。(要有过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:_____________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2 中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2 为________(填“正盐”或“酸式盐”),其溶液显 ________(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a-Fe(III)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为①H2 (g)=2H(g) △H1,②N2(g)+2H(g)2(NH)(g) △H2, ③(NH)(g)+H(g)![]() (NH2)(g) △H3, ④(NH2)(g)+H(g)
(NH2)(g) △H3, ④(NH2)(g)+H(g) ![]() NH3 (g) △H4,总反应为N2 (g)+3H2(g)
NH3 (g) △H4,总反应为N2 (g)+3H2(g)![]() 2NH3 (g) △H。下列说法正确的是
2NH3 (g) △H。下列说法正确的是
A. 催化剂能够有效降低反应的活化能和改变反应的焓变
B. 增大压强和使用高效催化剂均有利于提高总反应的平衡转化率
C. 反应①和总反应均为放热反应
D. △H=3△H1+△H2+2△H3+2△H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com