
����Ŀ��������500mL 0.2mol/L��Na2CO3��Һ���ش��������⣺
(1)ͨ�������֪��Ӧ��������ƽ��ȡ___________g Na2CO3��
(2)���õ���ƽ�⣬��һ�����õ��IJ����������ձ�����������_____________��_______________
(3)���в���ʹ������ҺŨ��ƫ�����_____________(��д���)��
A����ȡ28.6g Na2CO3��10H2O��������
B������ʱ�������������
C��������ƿת����Һʱ��������Һ�彦��
D��Na2CO3����������
E��δϴ���ܽ�Na2CO3���ձ�
F������ʱ���ӿ̶���
G������ƿδ���T����������Һ
H��������ҩƷλ�÷ŷ�������������
���𰸡�10.6 500 mL����ƿ ��ͷ�ι� BF
��������
��1��ͨ��n=cV��m=nM�����㣻
��2����������һ�����ʵ���Ũ�ȵ���Һ�������裬�ж���Ҫ�IJ������������õ��IJ��������У�����ƿ������������ͷ�ιܡ��ձ����ݴ˽����жϼ��ɣ�
��3������c=![]() �ɵã�һ�����ʵ���Ũ����Һ���Ƶ����������ʵ����ʵ���n����Һ�����V����ģ�������ʱ���ؼ�Ҫ�����ƹ���������n��V�����ı仯����n������ֵС����V������ֵ��ʱ������ʹ������ҺŨ��ƫС����n������ֵ��V������ֵСʱ������ʹ������ҺŨ��ƫ��
�ɵã�һ�����ʵ���Ũ����Һ���Ƶ����������ʵ����ʵ���n����Һ�����V����ģ�������ʱ���ؼ�Ҫ�����ƹ���������n��V�����ı仯����n������ֵС����V������ֵ��ʱ������ʹ������ҺŨ��ƫС����n������ֵ��V������ֵСʱ������ʹ������ҺŨ��ƫ��
��1��500mL 0.2mol/L��Na2CO3��Һ�к���Na2CO3�����ʵ���Ϊ��0.2mol/L��0.5L=0.1mol����Ҫ̼���Ƶ�����Ϊ��106g/mol��0.1mol=10.6g��
��2������500mL 0.2mol/L��Na2CO3��Һ�����У����㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣨������Ͳ��ȡˮ������ȴ��ת�Ƶ�500mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�
������Ҫ������Ϊ��������ƽ��ҩ�ס��ձ���Ͳ����������������ƿ����ͷ�ιܣ�
�ʴ�Ϊ��500 mL����ƿ����ͷ�ιܣ�
��3��A������500mL 0.2mol/L��Na2CO3��Һ�������Na2CO3�����ʵ���n=cV=0.5L��0.2mol/L=0.1mol���������Na2CO310H2O�������ƣ�����1mol Na2CO310H2O��1mol Na2CO3������Ҫ��Na2CO310H2O�����ʵ���ҲΪ0.1mol������m=nM=0.1mol��286g/mol=28.6g���ʳ�ȡ28.6g Na2CO310H2O�������ƣ����õ���Һ��Ũ������ȷ�ģ�ѡ��A��ѡ��
B�����������������ʳ�������ҩƷ������ƫ�����Ƶ���Һ��Ũ��ƫ��ѡ��Bѡ��
C��������ƿת����Һʱ��������Һ�彦��������������ʧ����������ҺŨ��ƫС��ѡ��C��ѡ��
D��Na2CO3�к��в��������ʣ��ᵼ�³�����Na2CO3����������ƫС����������ҺŨ��ƫС��ѡ��D��ѡ��
E��δϴ���ܽ�Na2CO3���ձ����ᵼ��Na2CO3����ʧ������������ҺŨ��ƫС��ѡ��E��ѡ��
F������ʱ���ӿ̶��ߣ��ᵼ����Һ���ƫС����Ũ��ƫ��ѡ��Fѡ��
G������ƿδ���T����������Һ����������Һ��Ũ����Ӱ�죬��ΪֻҪ�ڶ���ʱ����Һ�������500mL���ɣ�����ˮ��ԭ������ƿ���еĻ��Ǻ�������ģ��Խ����Ӱ�죬ѡ��G��ѡ��
H��������ҩƷλ�÷ŷ������������룬�ᵼ�³�����ҩƷ������ƫС��������Һ��Ũ��ƫ�ͣ�ѡ��H��ѡ��
��ѡBF��


 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ��aA(g)+bB(g)![]() cC(g)(��H<0)�ڵ��������½��С��ı�������Ӧ����������������������ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
cC(g)(��H<0)�ڵ��������½��С��ı�������Ӧ����������������������ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��

�ش����⣺
��1����Ӧ�Ļ�ѧ����ʽ�У�a��b��cΪ����
��2��A��ƽ����Ӧ����v��(A)��v��(A)��v��(A)�Ӵ�С���д���Ϊ����������������������������
��3��B��ƽ��ת��������(B)������(B)������(B)����С����������������ֵ������������
��4���ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ�������������������ȡ�Ĵ�ʩ������������
��5���Ƚϵ����η�Ӧ�¶�(T2)�͵����η�Ӧ�¶�(T3)�ĸߵͣ�T2������T3(����>����<������=��)���жϵ�����������
��6���ﵽ������ƽ����������������һ�����ٶ�10 min��ﵽ�µ�ƽ�⣬������ͼ�������߱�ʾ��������ϵ�и����ʵ�Ũ����ʱ��仯������(�����ϱ�����A��B��C)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ĵ�ʢ���屶�ӡ����屶��Ϊԭ�Ͽ��Ƶû�����A��A�Ľṹ��ʽ����ͼ��ʾ���������и��⣺

��1��A�ķ���ʽ��__________________��
��2���л�������B������������¼��ȷ���������Ӧ�ɵõ�A����д��B�Ľṹ��ʽ_________________��
��3����д��A�����NaOH��Һ��Ӧ�Ļ�ѧ����ʽ_________________��
��4���л�������C�Ǻϳ�����������ҩ���ԭ��֮һ��C���Կ�����B�����������ʵ���֮��1��2�����ӳɷ�Ӧ�õ��IJ��C���������ǻ���̼̼˫��ֱ�������Ľṹ����������ˮ��Ӧʹ��ˮ��ɫ����д��C����ˮ��Ӧ�Ļ�ѧ����ʽ: _________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״�����У���6.72LCH4����3.01��1023���Ȼ�����ӣ���13.6gH2S���ӣ���0.2molNH3�����ж���������Ĺ�ϵ��С���������ȷ���ǣ� ��
A.������ܢ٢ڢ�B.���������٢ܢۢ�
C.�������ܢ٢ۢ�D.��ԭ�Ӹ������ڢܢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.0g��������Ϊ14.0%��KNO3��Һ��30.0g��������Ϊ24.0%��KNO3��Һ��ϣ��õ����ܶ�Ϊ1.01 g/cm3�Ļ����Һ�����㣺
(1)��Ϻ���Һ������������_____
(2)��Ϻ���Һ�����ʵ���Ũ�ȡ�______
(3)��1000gˮ�����ܽ����Ħ��KNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ����ȣ�____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5���л���ѧ������
�ҹ���ѧ���ںϳɡ���������ҽ�ò��ϡ����������ܼ���DEHCH����������Ҫ��չ�������ܼ������л���D��L�Ʊ�����ṹ��ʽ���£�

��1���л���D��һ�ֺϳ�·�����£�

��֪��
��R��R��ʾ�������⣩
����C2H4����A�Ļ�ѧ����ʽ��________��
���Լ�a��________
��д��B�����������ŵ�����________��
���л���D�Ľṹ��ʽ��________��
��2�����ܼ���DEHCH���ĺϳ�·�����£�
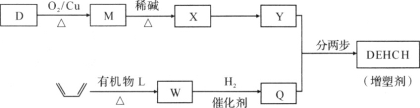
��֪��
��D��M�Ļ�ѧ����ʽ��________��
���л���L�ķ���ʽΪC4H2O3���˴Ź���������ʾֻ��һ�ֻ�ѧ��������ԭ�ӡ�W�Ľṹ��ʽ��________��
����Y��QΪԭ�Ϻϳ�DEHCH��Ϊ������Ӧ��д���йػ�����Ľṹ��ʽ��

�м����Ľṹ��ʽ��________����Ӧa�ķ�Ӧ������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ַǽ��������������������ϡ��������ҵ������
��l��Se��Ԫ�����ڱ��е�34��Ԫ�أ����̬ԭ�ӵĺ�������Ų�ʽΪ__��
��2�����ݼ۲���ӶԻ������ۣ�������֪SeO3�ķ��ӿռ乹��Ϊ__������Seԭ�Ӳ��õĹ���ӻ���ʽΪ__��
��3��CSe2��CO2�ṹ���ƣ�CSe2�����ڦҼ���м�����֮��Ϊ__��CSe2�״�����H2Se��CCl4��Ӧ����ȡ�ģ�CSe2�����ڵ�Se��C��Se����__������ڡ��������ڡ���С�ڡ���H2Se�����ڵ�H��Se��H���ǡ�
��4������慨������ڷ�өʯ�ͽṹ�������ṹ��ͼ��ʾ��ÿ�������а���__��Rb2Se��Ԫ������Se2����Χ���������������ȵ�Rb+��������ĿΪ__��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ҳ��õ���ȡ�������й��ڱ���˵���������( )
A. ��������Һ�壬�ܶȱ�ˮСB. ����ʹ���������Һ��ɫ
C. �ܺ�Һ�巢���ӳɷ�ӦD. �ܺ����ᷢ��ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����庬��65%��̼18%����10%����3%����1.5%����1%����0.35%����0.25%����0.15%����0.15%��þ0.05%�����DZ���Ϊ���峣��Ԫ�ء�
��1������Ĺ���Ԫ�أ������ڱ�������Ԫ����Ŀ�����Ϊ___________ �塣���ڵ������ڵķǽ���Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳��______________�����廹��������Ԫ��,���о����е�һ��____________��
��2��������ߵ�Ԫ��ԭ�Ӻ����˶�״̬��___________�֣��������ӹ����ʾʽ_____________������ͬ�����һ��Ԫ�صĻ�����_______>_______��(��Ԫ�ط��ű�ʾ)������һ����ʵ˵���ý���______��
��3������ǰ3λ��Ԫ�ذ�ԭ�Ӹ�����1��1��2�γɵ����ʵ�������_____________(д��һ�ּ���)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com