
【题目】常温下,将HC1气体通入到1L浓度均为0.1mol/L的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
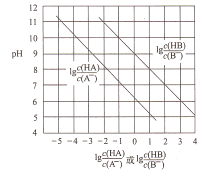
A. Ka(HB)的数量级为10-9
B. 酸性的强弱顺序为HCl>HA>HB
C. 当通入0.1molHC1气体时,c(B-)>c(A-)
D. 当混合溶液呈中性时,c(Na+)=c(Cl-)+c(A-)+c(B-)
【答案】C
【解析】A、根据图像可知,当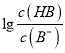 =3时,pH=6,此时,c(H+)=10-6mol/L,
=3时,pH=6,此时,c(H+)=10-6mol/L, 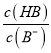 =103,Ka(HB)=
=103,Ka(HB)= 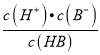 = 10-6×10-3=10-9,故A正确;B、pH一定时,
= 10-6×10-3=10-9,故A正确;B、pH一定时, 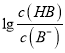 >
>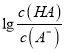 ,则有
,则有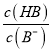 >
>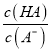 ,
, 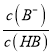 <
<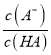 ,式子两边都乘以c(H+),可得
,式子两边都乘以c(H+),可得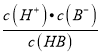 <
<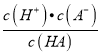 ,即Ka(HB)<Ka(HA),所以酸性HA>HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,故B正确;C、原溶液中NaA和NaB均为0.1mol,根据强酸制弱酸原理,通入0.1molHCl,H+先与B-反应,反应后溶液中溶质为0.1molNaA、0.1molNaCl、0.1molHB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-<c(A-),故C错误;D、混合溶液的电荷守恒为:c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),当溶液呈中性时,c(H+)= c(OH-),所以有c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),故D正确。故选C。
,即Ka(HB)<Ka(HA),所以酸性HA>HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,故B正确;C、原溶液中NaA和NaB均为0.1mol,根据强酸制弱酸原理,通入0.1molHCl,H+先与B-反应,反应后溶液中溶质为0.1molNaA、0.1molNaCl、0.1molHB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-<c(A-),故C错误;D、混合溶液的电荷守恒为:c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),当溶液呈中性时,c(H+)= c(OH-),所以有c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),故D正确。故选C。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,金属性最强的元素是_____,最活泼的非金属元素是_______________
(2)化学性质最不活泼的元素是______________,其原子的原子结构示意图为___________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是______________,碱性最强的是____________,
(4)在③~⑦元素中,原子半径最大的是________,原子半径最小的是_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制500 mL 1 mol /L NaOH溶液,下列叙述正确的是
A.用托盘天平称量20.0 g NaOH固体
B.溶解后不需要冷却至室温,可立即转移至容量瓶
C.转移溶液时不需要使用玻璃棒引流
D.定容完毕并摇匀后发现液面低于刻度线,再补加几滴水至刻度线,对实验结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. a点无ZnS沉淀生成
B. 可用MnS除去MnCl2溶液中混有的少量ZnCl2
C. 向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
D. CuS和MnS共存的悬独液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列问题:
(1)J元素的元素的名称:___________。
(2)G元素与I 元素形成的化合物的电子式是___________,
A、G、E形成的化合物中含有的化学键类型为_____________________________。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,
属于两性氢氧化物的是_______________(用化合物的化学式表示)。
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________极(填正或负),并写出该电极反应式为:____________________。
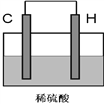
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一定温度和压强下,反应aX+bY![]() cZ的速率—时间图象,下列叙述正确的是
cZ的速率—时间图象,下列叙述正确的是
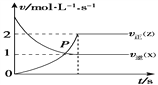
A. 该反应从正反应开始
B. a∶c=1∶2
C. 开始时,X的浓度为0,逆反应速率最小
D. 两条曲线相交的点P表示反应达到化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物其焰色反应均为紫色,A、B、C和盐酸反应均得到D,将固体C加热可得到A,若向A的溶液中通入一种无色无味气体,又可制得C,若B与C的溶液混合可制得A,试推断:
(1)A是 , B是 , C是 , D是 .
(2)完成有关化学方程式:C→A , A→C , B+C→A .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。下列推断不正确的是

A. 若D是白色沉淀,D与A的摩尔质量相等,则X可能是铝盐
B. 若X是Na2S,C是气体,则A可能是氯气,且D和E能发生反应
C. 若D为CO,C能和E反应,则A是Na2O2,X的同素异形体只有3种
D. 若A是单质,B和D的反应是生成C,则E能还原Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究表明,有毒气体H2S具有参与调节神经信号传递、舒张血管减轻高血压的功能。
(1)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是______(填标号)。
A.H2S 的还原性强于H2SO3
B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1
C.H2S 不能与NaHCO3溶液反应,而H2SO3可以
D.等浓度的两种溶液pH 值: NaHS > NaHSO3
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知(1)式和(5)式的热化学方程式分别为___________、________________,制得等量H2所需能量系统I是系统II的_______倍。
(3)H2S与CO2在高温下发生反应: H2S(g)+CO2(g) ![]() COS(g) +H2O(g) △H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
COS(g) +H2O(g) △H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
①H2S的平衡转化率a1=_______%,反应平衡常数K=______________。
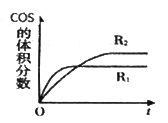
②在不同条件下发生上述反应,COS 的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是____________(填字母序号)CO2的转化率a2__a1,(填”>”或“<”)
A.压强 B.温度 C.催化剂
(4)反应开始,保持T1温度,2L 钢瓶中充入0.08molCO2、0.40mo1H2S、0.02molCOS和0.02molH2O,则此时V正___V逆(填”>”或“<”)判断依据是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com