
【题目】(1)图甲为晶体的二维平面示意图,所表示物质的化学式可能为AX2的是______(填“a”或“b”)。

(2)图乙为金属铜的晶胞示意图,请回答下列问题。
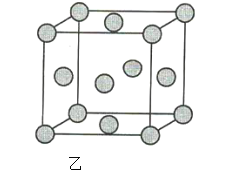
①该晶胞实际含有的铜原子数是______。
②该晶胞称为______(填序号)。
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞 D.简单立方晶胞
③该晶胞的边长为a cm, Cu的摩尔质量为64g·mol-1,金属铜的密度为pg·cm-3,则阿伏加德罗常数为___(用含a、p的代数式表示)。
【答案】a 4 C ![]()
【解析】
(1)由图中直接相邻的原子数可求得a、b中A、X个数之比分别为1:2、1:3,则其所代表物质的化学式分别可能为AX2,、AX3。
(2)①采用切割法,则该晶胞实际含有的铜原子数为8×1/8+6×1/2=4。②该晶胞为面心立方晶胞。③由![]() ,解得
,解得![]() 。
。
(1)a中每个白色小球被3个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为![]() ,表示的化学式为AX2,b中每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为
,表示的化学式为AX2,b中每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为![]() ,表示的化学式为AX3,故答案为:a;
,表示的化学式为AX3,故答案为:a;
(2)①根据图乙可知,该晶胞中含有6个半球,8个![]() 球,则该晶胞中Cu原子的个数为
球,则该晶胞中Cu原子的个数为![]() ,故答案为:4;
,故答案为:4;
②该晶胞属于面心立方晶胞,故答案为:C;
③晶胞体积为a3 cm3,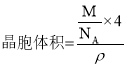 ,则
,则![]() ,故答案为:
,故答案为:![]() 。
。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下面是A~G七种元素的电子排布:
元素 电子排布 电子层 | A | B | C | D | E | F | G |
K | 1 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 4 | 5 | 6 | 8 | 8 | 8 | |
M | 1 | 3 | 7 |
试根据由上述元素构成的物质的化学式回答下列问题。
(1)写出一种常见的由非极性键形成的双原子分子:____________________。
(2)写出一种由极性键形成的双原子分子:____________________。
(3)写出一种由极性键形成的三原子分子:____________________。
(4)写出一种由三种元素形成的既含离子键又含共价键的化合物:__________,其电子式为____________________。
(5)写出一种既含离子键又含非极性键的化合物:__________,其电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
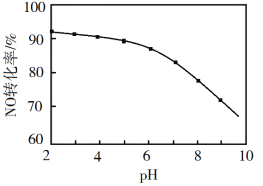
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为__;F的结构式为__。
(2)A与B生成D的反应在工业上是生产__的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为__。
(4)B和C反应的化学方程式为__。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子的电子排布式: _______________________________________。
(2)b的氧化物中b原子与氧原子之间的共价键类型是__________________________其中b原子的杂化方式是____________________________________________。
(3)a的单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。

若已知a元素原子的半径为d,NA代表阿伏加德罗常数,a元素原子的摩尔质量为M,则1个晶胞中a原子的数目为____________________________,该晶体的密度为____________________________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①在T℃下,0~2s时,该反应的平均反应速率![]() =________;
=________;
②该温度下反应的平衡常数K=________,在T℃下,能提高NO的平衡转化率的措施有_______、________。
(3)已知NO和O2反应的历程如图,回答下列问题:
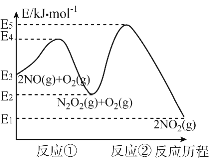
①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____(选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜三种金属元素在日常生活中的应用最为广泛。回答下列问题:
(1)基态Fe原子的简化电子排布式为__________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式_________;Fe(CO)5分子中σ键与π键之比为_______。
(3)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_______。NO3-中心原子的轨道杂化类型为________。
②与NH3互为等电子体的一种阴离子为_______(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因________。
(4)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
(5)铁和硫形成的某种晶胞结构如图所示,晶胞参数a=xpm,则该物质的化学式为_______;A原子距离B原子所在立方体侧面的最短距离为______pm(用x表示);该晶胞的密度为____g·cm-3。(阿伏加德罗常数用NA表示)
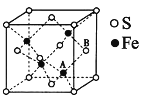
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、R是原子序数依次增大的短周期元素。a、b、c、d、e、f是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,f是由W、Z、R元素形成的化合物。m为元素Z形成的单质,W与X能形成化合物XW4。上述物质的转化关系如图所示,下列说法正确的是( )
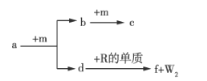
A.简单离子半径: R>Z
B.最高价氧化物对应水化物的酸性:X>Y
C.![]() 为离子化合物,含有离子键和共价键
为离子化合物,含有离子键和共价键
D.符合通式XnWn的化合物均能使溴的CCl4溶液因发生反应而褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com