
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| H-H | 436 | C-F | 427 | H-S | 339 |
| S=S | 255 | C-C1 | 330 | H-F | 565 |
| C1-C1 | 243 | C-I | 218 | H-C1 | 431 |
| O=O | ? | H-O | 464 | H-Br | 366 |
分析 (1)根据旧键断裂和新键生成释放的能量之差即为反应焓变来判断;
(2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,可以此来书写热化学方程式并计算反应热;
(3)RF、RCl、RBr、RI(R相同)的反应活性与卤代烃R-X键的键能大小有关;
(4)①同主族元素的单质从下到上,和氢气化合越来越容易,释放的热量越来越多,据此回答判断;
②化学反应的反应热等于反应物的键能之和与生成物的键能之和的差;
③旧键断裂和新键生成释放的能量之差即为反应焓变,根据热化学方程式的书写方法来回答.
解答 解:(1)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,热化学方程式H2(g)+Cl2(g)=2HCl(g);△H=427kJ/mol+218kJ/mol-2×431kJ/mol=-183kJ/mol,氢气在氯气中燃烧的热化学方程式为:H2(g)+C12(g)=2HC1(g)△H=-183 kJ•mol-l,
故答案为:H2(g)+C12(g)=2HC1(g)△H=-183 kJ•mol-l;
(2)由表中数据可得:2H2(g)+S2(g)=2H2S(g);△H=-229KJ•mol-1,又知2H2(g)+S2(s)→2H2S(g);△H=-224.5KJ•mol-1,则S2(s)→S2(g);△H=+4.5kJ/mol,1mol S2(s)气化时将吸收4.5kJ的能量,
故答案为:吸收;4.5;
(3)R相同时,卤素互化物的键能越大,越不易断裂,反应活性越小,所以RI>RBr>RCl>RF,
故答案为:RI>RBr>RCl>RF;
(4)①同主族元素的单质从下到上,和氢气化合越来越容易,释放的热量越来越多,表示生成1mol碲化氢反应热的是a,故答案为:a;
②化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,H2分别与O2(g)反应生成1mol气态氢化物的反应热是-241.8kJ•mol-1,假设O=O的键能为x,所以2×436+x-464×4=-241.8kJ•mol-1,解得x=500.4 kJ•mol-l,故答案为:500.4 kJ•mol-l;
③旧键断裂和新键生成释放的能量之差即为反应焓变,2H2S(g)+O2(g)=S2(s)+2H2O(g),△H=(4×339+500.4-255-4×464)kJ/mol=-259.1 kJ•mol-l,
故答案为:2H2S(g)+O2(g)=S2(s)+2H2O(g)△H=-259.1 kJ•mol-l.
点评 本题考查新信息数据处理能力,根据反应的数据得出根据键能计算反应的规律,难度不大.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| B. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
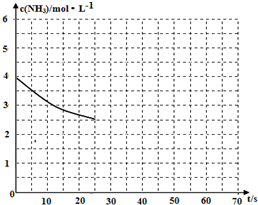 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 乙烯和乙醛均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com