
【题目】能够测定分子结构和化学键的方法是( )
A.质谱法B.红外光谱C.核磁共振氢谱D.元素定量分析法
科目:高中化学 来源: 题型:
【题目】物质 R2CO3 的饱和溶液 V mL,密度为 ρ g·cm-3 , R+的物质的量浓度为 c mol·L-1 ,溶质的质量分数为 a% ,溶质的相对分子量为 M,溶质的溶解度为 s g。则下列表达式正确的是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,由相同种类元素组成的是
A. 胆固醇、脂肪酸、脂肪酶 B. 性激素、生长激素、胰岛素
C. 氨基酸、核苷酸、丙酮酸 D. 淀粉、半乳糖、糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A. 灼热的碳与CO2的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 铝片与稀盐酸反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅰ]凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3=NH3·H3BO3;NH3·H3BO3+HCl= NH4Cl+ H3BO3。

回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为c mol·L–1的盐酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【山西省实验中学2017届下学期模拟热身】五种短周期元素A、B、C、D、E的性质及结构信息如下:
① 原子半径A>B>C>D>E;
② 五种元素之间形成的常见的四种分子如下:
甲 | 乙 | 丙 | 丁 | |
比例模型 |
|
|
|
|
组成元素 | D、E | B、E | A、D、E | C、E |
电子总数 | 10 | 18 | 26 | 10 |
请根据上述信息回答下列问题:
(1)A元素的单质与物质甲发生反应的离子方程式为_______,其化学反应平衡常数的表达式为___。
(2)戊与乙互为同系物,有五种同分异构体,戊的分子式为_____,己与乙具有相同的电子数,与甲含有的元素种类相同,己分子的结构式为_______。
(3)C与E元素组成的CE3与液氮可组成燃料电池,产物均为无污染的物质,可用于驱动潜艇,燃料电池装置如下图所示。该电池的负极反应式为_____。电池工作时OH-向_____移动(填“正极”或“负极”)。

(4)B与D组成的一种物质在自然界中可循环,循环时其与CaCO3反应。已知Ksp(CaCO3)=2.8×10-9,现将CaCl2溶液与Na2CO3溶液等体积混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀的最小浓度为__________(忽略混合前后溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】碳、氮及其化合物是同学们经常能接触到的重要物质,是科学研究的重要对象。
(1)实验室制取乙炔的化学方程式为___________________________。
(2)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图A所示。用CO2和氨气合成尿素的热化学方程式为___________________________。
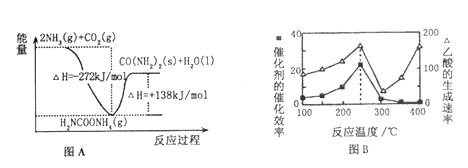
(3)合理利用CO2、CH4,抑制温室效应成为科学研究的新热点。一种以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸(△H<0)。在不同温度下催化剂的催化效率与乙酸的生成速率分别如上图B所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。250℃和400℃时乙酸的生成速率几乎相等,实际生产中应选择的温度为_________℃。
(4)T℃时,将等物质的量的NO和CO充入体积为2L的 密闭容器中发生反应2NO+2CO![]() 2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
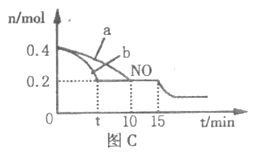
①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将______(填“向左”、“向右”或“不”)移动。
②图中a、b分别表示在一定温度下,使用相同质量、不同表面积的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____________(任答一条即可)。
(5)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,可用电解原理将溶液中的氨氮物质完全氧化除去。该过程分为两步:第一步:电解产生氯气;第二步:利用氯气将氨氮物质氧化为N2。
①第二步反应的化学方程式为____________________。
②若垃圾渗滤液中氨氮物质的质量分数为0.034% ,理论上用电解法净化It该污水,电路中转移的电子数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com