
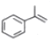
 (异丙烯苯)$→_{一定条件}^{+H_{2}}$
(异丙烯苯)$→_{一定条件}^{+H_{2}}$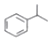 (异丙苯),下列说法错误的是( )
(异丙苯),下列说法错误的是( )| A. | 反应属于加成反应 | B. | 异丙苯的一氯代物共有6种 | ||
| C. | 可用溴水鉴别异丙烯苯和异丙苯 | D. | 异丙苯是苯的同系物 |
分析 A.异丙烯苯和氢气一定条件下反应生成异丙苯是发生了加成反应;
B.异丙苯分子中含5种氢原子;
C.溴水中的溴单质和碳碳双键发生加成反应;
D.苯的同系物是含一个苯环,组成上相差CH2的烃.
解答 解:A.已知 (异丙烯苯)$→_{一定条件}^{+H_{2}}$
(异丙烯苯)$→_{一定条件}^{+H_{2}}$ (异丙苯),是碳碳双键被氢气加成,发生的是加成反应,故A正确;
(异丙苯),是碳碳双键被氢气加成,发生的是加成反应,故A正确;
B.异丙苯分子中含5种氢原子,一氯代物共有5种,故B错误;
C.异丙烯苯含碳碳双键,溴水中的溴单质和碳碳双键发生加成反应,溴水褪色,异丙苯和溴水发生萃取分层 现象,可用溴水鉴别异丙烯苯和异丙苯,故C正确;
D.异丙苯符合CnH2n-6通式,是含一个苯环,组成上相差CH2的烃,是苯的同系物,故D正确;
故选B.
点评 本题考查了物质结构、性质、鉴别和同分异构体等知识点,注意苯的同系物使溴水褪色的原理是萃取分层,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LHA溶液的pH=3.5 | |
| B. | 0.1mol/LHA溶液中,由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 0.1mol/LNaA溶液中,各离子浓度大小顺序为:c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 向0.1mol/LNaA溶液中加水稀释,所有离子浓度均降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
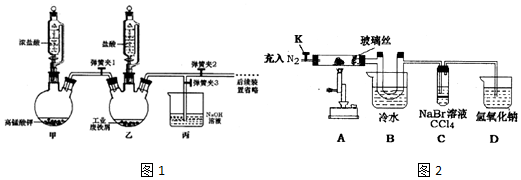
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因排出装置内的空气 |
| 关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因FeC13易升华 |
| 实验结束,振荡C静置 | ③溶液分层,上层接近无色,下层橙红色 | ④2FeC13$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-(用相关的方程式说明) |
| ⑤结合以上实验和文献资料,该固体可以确定的成分有FeC13、Fe2O3. | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有水分子数为NA | |
| B. | 1mol Na2CO3 固体中含有的钠离子数为NA | |
| C. | 16g O2中含有的氧原子数为NA | |
| D. | 0.1mol/L的NaOH溶液中含有OH-的数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子直径大于100nm | |
| B. | 丁达尔效应可以用于检验胶体 | |
| C. | 将FeCl3溶液滴加到氢氧化钠溶液中即可制得氢氧化铁胶体 | |
| D. | 分离胶体和溶液可以采用过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
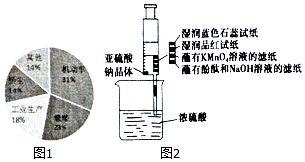 晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.
晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 气体的总体积 | ||
| C. | 混合气体的相对分子质量 | D. | 气体的总物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com