
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
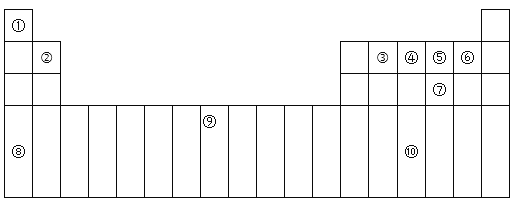
(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
【答案】F 26 4s24p3 H2O H2O 离子 低
【解析】
根据元素在周期表中的位置可知,①为H元素,②为Be元素,③为C元素,④为N元素,⑤为O元素,⑥为F元素,⑦为S元素,⑧为K元素,⑨为Fe元素,⑩为As元素,结合元素周期表以及元素的性质进行答题。
(1)非金属性越强,电负性越大。在所给的元素中,氟元素的非金属性最强,则电负性最大的是氟元素,化学式为F,故答案为:F。
(2)由分析可知:⑨为Fe元素,铁元素的原子序数为26,原子核外有几个电子,其原子核外电子就有几种运动状态,所以Fe元素有26种运动状态不同的电子,故答案为:26。
(3)由分析可知:⑩为As元素,As为第四周期第ⅤA族元素,所以原子核外价电子排布式为4s24p3,故答案为:4s24p3。
(4)由分析可知:⑤为O元素、⑦为S元素,同一主族的元素,非金属性逐渐减弱,非金属性越强,形成的氢化物越稳定,非金属性:O>S,所以O和S元素形成的氢化物中较稳定的是H2O;根据组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高,但水中含有氢键,使得水的熔沸点变大,所以沸点较高的是H2O,故答案为:H2O,H2O。
(5)分析可知:⑦为S元素、⑧为K元素,由S元素和K元素形成的化合物为K2S,属于离子晶体,K2S和Na2O均属于离子化合物,离子电荷相同,离子半径K+>Na+,S2->O2-,Na2O的晶格能比K2S的大,所以K2S的熔点比Na2O的低,故答案为:低。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 乙酸与碳酸钠溶液反应:2H++CO32—== CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O →2C6H5OH+CO32—
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-![]() CO32—+2NH4++4Ag↓+6NH3+2H2O
CO32—+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,固定容积的密闭容器中发生下列反应:![]() 反应过程中,各物质浓度与时间的关系如图:
反应过程中,各物质浓度与时间的关系如图:
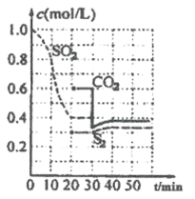
(1)该反应平衡常数表达式为![]() ____________。
____________。
(2)![]() 化学反应速率表示
化学反应速率表示![]() ______;建立平衡过程中,混合气体的密度______(选填“增大”、“减小”或“不变”)。
______;建立平衡过程中,混合气体的密度______(选填“增大”、“减小”或“不变”)。
(3)![]() 时改变外界条件,使
时改变外界条件,使![]() ______
______![]() (选填“大于”、“小于”或“等于”)。
(选填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个容积为2L的密闭容器中充入2mol NH3和3 mol O2,在恒温和催化剂作用下发生反应:4NH3(g)+5O2(g)4NO(g) + 6H2O(l) ,经过5min后达到平衡状态。此时,c(NH3):c(O2)=4:7。则:
(1)反应开始至平衡时,以NO的浓度变化表示该反应的平均速率v(NO)=__________。
(2)起始状态与平衡状态容器内的压强之比为______。
(3)该条件下反应一段时间,下列能说明反应达到平衡状态的是___________ 。
A.c(H2O)保持不变的状态 B.气体的压强保持不变的状态
C.4v正(NH3)=5v逆(O2) D.NH3与O2浓度之比保持不变的状态
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
A | B | C | D | E | F | |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1 = _________ ,V6 = _________ 。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )
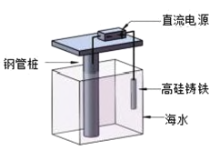
A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素。其中X是形成化合物种类最多的元素,Y原子基态时2p原子轨道上有3个未成对的电子,Z单质占空气体积的![]() ,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的电负性从大到小的顺序是___ (用元素符号表示,下同),三种元素的第一电离能由大到小的顺序为______。
(2)写出X的电子排布式_____。
(3)W同周期的元素中,与W原子最外层电子数相等的元素还有_____。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是____(用化学式表示),原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-,SO42-和NO3-的相互分离,实验过程如下:
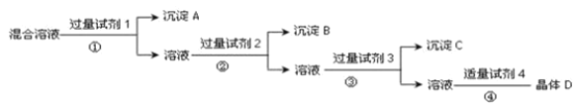
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:试剂1为 ___,试剂2为___,试剂4为_________。
(2)加入过量试剂3的目的是_________ 。
(3)在加入试剂4后,获得晶体D的实验操作④的名称是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
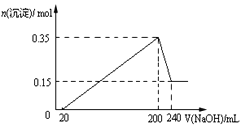
A. 生成的氢气在标准状况下的体积为11.2L
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. Mg和Al的总质量为9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属在人类生产生活中得到了广泛应用,请你回答下列问题。
(1)面包发酵粉的主要成分之一是一种钠盐,其俗称为________;漂白粉的有效成分为__________(写化学式);FeCl3常用作净水剂,其原理为_________(用离子方程式表示)。
(2)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是_________。
(3)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(4)某CuSO4、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液中阳离子的浓度为___________mol/L,若向此溶液中加入金属Zn,则最多溶解Zn的质量为____________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com