
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
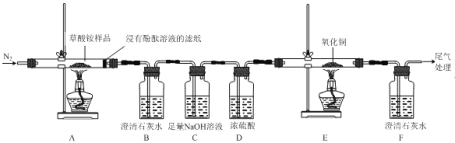
(1)实验证明草酸铵分解产物有:NH3、CO2、CO和水,其中说明分解产物中有CO的实验现象是__。
(2)装置C中发生反应的离子方程式为_____。
Ⅱ.该同学利用草酸铵测定某品牌牛奶中钙的含量,实验步骤如下:
①取100 mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.100mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗KMnO4溶液16.00mL。
已知:H++![]() +H2C2O4——Mn2++CO2+H2O(未配平)
+H2C2O4——Mn2++CO2+H2O(未配平)
(3)计算该品牌牛奶中钙的含量(单位:g·L-1),写出计算过程_____。
【答案】E中黑色固体变红,F中澄清石灰水变浑浊 CO2+2OH-=![]() +H2O n(KMnO4) =0.100mol·L-1×16.00×10-3L=1.6×10-3mol ,n(H2C2O4) =
+H2O n(KMnO4) =0.100mol·L-1×16.00×10-3L=1.6×10-3mol ,n(H2C2O4) =![]() n(KMnO4) =4×10-3mol ,n(Ca2+)=n(H2C2O4) =4×10-3mol,m(Ca2+)=4×10-3mol×40 g·mol=0.16g,该品牌牛奶中钙的含量为=
n(KMnO4) =4×10-3mol ,n(Ca2+)=n(H2C2O4) =4×10-3mol,m(Ca2+)=4×10-3mol×40 g·mol=0.16g,该品牌牛奶中钙的含量为=![]() = 1.6 g·L-1
= 1.6 g·L-1
【解析】
草酸铵分解产物有NH3、CO2、CO和水,澄清石灰水用于检验二氧化碳,足量氢氧化钠溶液吸收二氧化碳,浓硫酸用于除水,氧化铜与一氧化碳反应生成二氧化碳和铜;![]() 与H2C2O4发生氧化还原反应,锰元素由+7价变为+2价,碳元素由+3价变为+4价,根据得失电子守恒,可得反应方程式为6H++2
与H2C2O4发生氧化还原反应,锰元素由+7价变为+2价,碳元素由+3价变为+4价,根据得失电子守恒,可得反应方程式为6H++2![]() +5H2C2O4=2Mn2++10CO2+8H2O。
+5H2C2O4=2Mn2++10CO2+8H2O。
(1)综上分析,说明草酸铵的分解产物中有CO的实验现象是E中黑色固体变红,F中澄清石灰水变浑浊。
(2)装置C中总量氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的离子方程式为CO2+2OH-=![]() +H2O。
+H2O。
(3)滴定过程中消耗高锰酸钾的物质的量为n(KMnO4) =0.100mol·L-1×16.00×10-3L=1.6×10-3mol,根据反应6H++2![]() +5H2C2O4=2Mn2++10CO2+8H2O可知,消耗的草酸的物质的量n(H2C2O4) =
+5H2C2O4=2Mn2++10CO2+8H2O可知,消耗的草酸的物质的量n(H2C2O4) =![]() n(KMnO4) =4×10-3mol,则n(Ca2+)=n(H2C2O4) =4×10-3mol,m(Ca2+)=4×10-3mol×40 g·mol=0.16g,该品牌牛奶中钙的含量=
n(KMnO4) =4×10-3mol,则n(Ca2+)=n(H2C2O4) =4×10-3mol,m(Ca2+)=4×10-3mol×40 g·mol=0.16g,该品牌牛奶中钙的含量=![]() = 1.6 g·L-1。
= 1.6 g·L-1。


科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 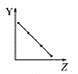 b.
b. 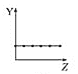 c.
c. 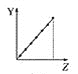 d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.用排饱和氯化铵溶液的方法收集氨气
C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火
D.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1~20号元素中![]() 、
、![]() 、
、![]() 、
、![]() 四种元素原子的质子数大小顺序为
四种元素原子的质子数大小顺序为![]() ;
;![]() 元素原子的最外层电子数是次外层电子数的2倍;
元素原子的最外层电子数是次外层电子数的2倍;![]() 元素原子的
元素原子的![]() 层电子数是
层电子数是![]() 层电子数的一半;
层电子数的一半;![]() 元素原子的次外层电子数比最外层电子数多1;
元素原子的次外层电子数比最外层电子数多1;![]() 元素原子的
元素原子的![]() 层、
层、![]() 层电子数之和等于
层电子数之和等于![]() 层、
层、![]() 层电子数之和。试推断:
层电子数之和。试推断:
(1)元素的名称:![]() ______,
______,![]() ______。
______。
(2)原子结构示意图:![]() ______,
______,![]() ______。
______。
(3)实验室制取![]() 的单质的化学方程式为______。
的单质的化学方程式为______。
(4)若没有“质子数大小顺序为![]() ”的限制,
”的限制,![]() 还可以是______元素。
还可以是______元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________,已知:K(300℃)>K(350℃),该反应是________反应(填“放热”或“吸热”)。
(2)下图中表示NO2的变化的曲线是___,用O2的浓度变化表示从0~2 s内该反应的平均速率v=__________。

(3)能说明该反应已经达到平衡状态的是(____)
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(____)
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在容积固定为2 L的密闭容器内充入1 mol N2和3 mol H2合成NH3。恒温下开始反应,并用压力传感器测定压强如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
下列说法不正确的是
A.不断地将NH3液化并移走,有利于反应正向进行
B.其它条件不变,在30 min时,若压缩容器的体积,N2的平衡转化率增大
C.从反应开始到10 min时,v(NH3)=0.035 mol·L1·min1
D.在30 min时,再加入0.5 mol N2、1.5 mol H2和2 mol NH3,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。回答下 列问题:
(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。(CN)2 中π键和σ键的数目之比为__________。沸点:(CN)2__________ (SCN)2(填“大于”、“等于”或“小于”),理由是__________。
(2)无机含氧酸的通式可写成(HO)mROn,如果成酸元素 R 相同,则 n 值越大,R 的正电性越高,在水中越容易电离出 H+。酸性强弱:HNO2____________HNO3(填“大于”、“等于”或“小于”);NO2-中氮原子的杂化方式为___________。
(3)一种硒单质晶体的晶胞为六方晶胞,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶 体结构图和晶体结构俯视图如下所示。

已知正六棱柱的边长为 a cm,高为 b cm,NA 表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3(用含 NA、a、b 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸及其盐的叙述不正确的是( )
A.硅酸是一种弱酸,可由其酸性氧化物![]() 与水化合而制得
与水化合而制得
B.硅酸盐是构成地壳中岩石的主要成分,黏土的主要成分是硅酸盐
C.陶瓷材料是人类应用最早的硅酸盐材料
D.高温结构陶瓷、生物陶瓷是新型无机非金属材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com