
分析 (1)加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大;
(2)正反应是放热反应,降低温度,平衡正向移动;
(3)①加入氯化铁,铁离子难度增大,平衡正向进行;硫氰酸钾难度减小;
②氯化钾对平衡无影响平衡不动.
解答 解:(1)加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色,故答案为:变深,因为增大生成物浓度,平衡逆向移动,Cr2O72-浓度变大,颜色变深;
(2)正反应是放热反应,降低温度,平衡正向移动,NO2浓度变小,气体的颜色变浅,故答案为:变浅,降温平衡正向移动,NO2浓度变小,颜色变浅;
(3)①FeCl3+3KSCN?Fe(SCN)3+3KCl反应,平衡为Fe3++3SCN-=Fe(SCN)3,滴入1mol/LFeC13溶液,铁离子浓度增大,平衡正向进行溶液颜色加深,平衡移动后KSCN浓度会减小,故答案为:变深,正;
②平衡为Fe3++3SCN-=Fe(SCN)3,加入KC1固体平衡不动,溶液颜色不变;故答案为:不变,不.
点评 本题考查化学平衡的影响因素,比较基础,注意建立平衡的微粒分析,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 9:15 | C. | 5:19 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
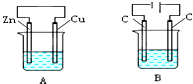 如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:
如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 300mL3.5 mol/L KCl溶液 | B. | 1000mL2.5mol/L NaCl溶液 | ||
| C. | 250mL1 mol/L AlCl3溶液 | D. | 200mL2mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
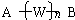 (其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
(其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )| A. | CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3 | |
| B. | CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3(CH=CH)3CHO | |
| C. | CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3 | |
| D. | ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HX可能是强酸 | B. | HY一定是强酸 | ||
| C. | HX的酸性强于HY的酸性 | D. | 反应开始时二者生成的速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 单质 | 氧化物 | 酸 | 碱 | 盐 | |
| A | HD | 水 | 硫酸 | 烧碱 | 胆矾 |
| B | 氯水 | NO2 | 盐酸 | 石灰水 | 水银 |
| C | 碘酒 | 一氧化碳 | 硝酸 | NH3•H2O | 食盐 |
| D | H2 | Fe3O4 | HNO3 | 纯碱 | 小苏打 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
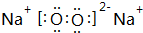 F的原子结构示意图为
F的原子结构示意图为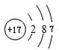 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com