
 金属及其化合物在人类生产、生产中发挥着重要的作用.
金属及其化合物在人类生产、生产中发挥着重要的作用.分析 (1)钠的氧化物有氧化钠和过氧化钠,铝的氧化物有氧化铝,铁的氧化物有氧化亚铁、氧化铁和四氧化三铁,其中过氧化钠具有极强的氧化性;适合作耐火材料的氧化物必须具有高熔点;
(2)NaHCO3不稳定,可加热除杂;
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,当铁少量时,铁先和铁离子反应,铜再和铁离子反应,当铁过量时,铁先和铁离子反应后和铜离子反应.
解答 解:(1)钠的氧化物有氧化钠和过氧化钠,铝的氧化物有氧化铝,铁的氧化物有氧化亚铁、氧化铁和四氧化三铁,其中过氧化钠具有极强的氧化性;适合作耐火材料的氧化物必须具有高熔点,故答案为:Na2O2,Al2O3;
(2)NaHCO3不稳定,可加热除杂,方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:加热,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
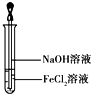
(3)氯化亚铁和氢氧化钠反应生成白色氢氧化亚铁沉淀,迅速变为灰绿色,氢氧化亚铁不稳定易被氧化生成氢氧化亚铁红褐色沉淀,涉及的反应方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3↓,
故答案为:试管中出现白色絮状沉淀,继而变成灰绿色,最后变成红褐色;
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,
A.加入铁和铜的混合物,铁首先与氯化铁反应,可能铁全部反应而铜有剩余,故A正确;
B.加入铁和铜的混合物,铁首先与氯化铁反应,铜后参加反应,不会出现有铁无铜的情形,故B错误;
C.若氯化铁的量少,加入的铁粉和铜粉可能剩余,故C正确;
D.若氯化铁的量多,加入的铁粉和铜粉全部参加反应,不会有剩余,故D正确;
故答案为:B.
点评 本题综合考查了金属及其化合物的性质,为高频考点,侧重于元素化合物知识的综合理解和运用高的考查,明确物质的性质是解本题关键,难点是(4)题的分析,注意离子反应的先后顺序,难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol | B. | 0.15 mol | C. | 0.22 mol | D. | 0.05 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(M+)>C(OH-)>C(A-)>C(H+) | B. | C(M+)>C(A-)>C(H+)>C(OH-) | ||
| C. | C(M+)>C(A-)>C(OH-)>C(H+) | D. | C(M+)+C(H+)>C(A-)+C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 用氢氧化钠溶液鉴别Al2(SO4)3和 MgSO4两种无色溶液 | |
| C. | 用焰色反应实验来鉴别NaNO3固体和 KNO3固体 | |
| D. | 用澄清石灰水鉴别碳酸钠和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
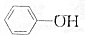 ,③
,③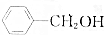 ,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )
,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )| A. | 3类 | B. | 4类 | C. | 5类 | D. | 6类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com