
| 实验 | 1、将一小块金属钠放入滴有酚酞溶液的冷水中. 2、将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. 3、将一小段镁带投入稀盐酸中. 4、将一小片铝投入稀盐酸中. |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
分析 (1)越是活泼的金属,和酸或者水反应越剧烈,置换出氢气越容易,生成碱的碱性越强;
(2)镁与水在加热条件下能够反应生成氢氧化镁和氢气;
(3)根据以上反应现象判断金属钠、镁、铝的活动性顺序;
(4)从原子半径和失电子能力角度来解释金属性强弱关系.
解答 解:(1)金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,和水及酸反应置换出氢气的程度是越来越难,所以:1对应的现象为②、2对应的现象为④、3对应的现象为①、4对应的现象为③,
故答案为:
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | ② | ④ | ① | ③ |
点评 本题考查同一周期元素性质的递变规律知识,题目难度不大,注意熟练掌握元素周期律的内容及其应用.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 密闭容器中发生反应H2+I2=2HI,增大压强时,容器中颜色加深 | |
| C. | 将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应 | |
| D. | 用过量空气煅烧硫铁矿可以提高硫铁矿的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:
某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
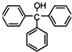 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示. ;
;
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
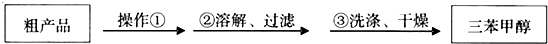
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 10 m 量筒量取 5.2 mL盐酸 | |
| B. | 用 100 mL量筒量取 5.2 mL盐酸 | |
| C. | 用托盘天平称取25.02g NaCl | |
| D. | 用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com