
【题目】向一容积不变的密闭容器中加入![]() 、
、![]() 和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为
和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为![]() 时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知只有
时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知只有![]() 阶段为使用催化剂;图一中
阶段为使用催化剂;图一中![]() 阶段
阶段![]() 未画出。
未画出。
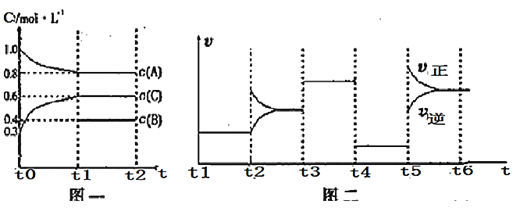
下列说法不正确的是
A.此温度下该反应的化学方程式![]()
![]()
B.![]() 阶段改变的条件为减小压强
阶段改变的条件为减小压强
C.B的起始物质的量为1mol
D.在相同条件下,若起始时容器中加入![]() 、
、![]() 和
和![]() ,要达到
,要达到![]() 时刻同样的平衡,a、b、c要满足的条件为
时刻同样的平衡,a、b、c要满足的条件为![]() 和
和 ![]()
【答案】A
【解析】
![]() 阶段与
阶段与![]() 阶段正逆反应速率都相等,
阶段正逆反应速率都相等,![]() 阶段的速率比原来快,则
阶段的速率比原来快,则![]() 阶段为使用催化剂,
阶段为使用催化剂,![]() 阶段的速率比原来慢,则
阶段的速率比原来慢,则![]() 阶段应为减小压强,即该反应为气体体积不变的反应;反应中A的浓度变化为
阶段应为减小压强,即该反应为气体体积不变的反应;反应中A的浓度变化为![]() ,C的浓度变化为
,C的浓度变化为![]() ,由图一可知,A为反应物,C为生成物,则A、C的化学计量数之比为2:3,又该反应为气体体积不变的反应,则B为反应物,状态为气态,该反应为
,由图一可知,A为反应物,C为生成物,则A、C的化学计量数之比为2:3,又该反应为气体体积不变的反应,则B为反应物,状态为气态,该反应为![]() 。
。
A.由上述分析可知,此温度下该反应的化学方程式为![]() ,故A错误;
,故A错误;
B.![]() 阶段改变的条件为减小压强,该反应为气体体积不变的反应,故B正确;
阶段改变的条件为减小压强,该反应为气体体积不变的反应,故B正确;
C.A减少![]() ,则B减少
,则B减少![]() ,则起始B的浓度为
,则起始B的浓度为![]() ,起始物质的量为
,起始物质的量为![]() ,故C正确;
,故C正确;
D.相同条件下,达到同样的平衡状态,则起始量相同即可,![]() 时刻同样的平衡,满足的条件为
时刻同样的平衡,满足的条件为![]() 和
和![]() ,故D正确;
,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
![]() bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是
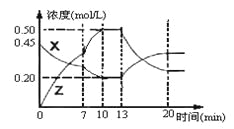
A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
B.化学方程式中a:b= 1:3,
C.推测在第7min时曲线变化的原因可能是增加X的浓度
D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)=2NO(g)。试通过计算说明在1 200 ℃的条件下,此反应能否正向自发进行?估算自发进行的最低温度是多少______?[已知该反应:ΔH=+180.50 kJ·mol-1,ΔS=247.7 J·mol-1·K-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究与深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
则该反应的平街常数表达式K=_________,H_________0(填“>”、“<”或“=”)。
(2)CO2可用于生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
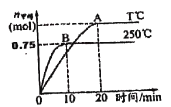
请分析并回答下列问题:
250°C时,反应在前10min的平均速率v(H2)_________molL-1min-1,从反应开始到平衡,CO2转化率为_________%。相同温度下,若某时刻该容器中含有1 mol H2、1.2mol CO2、0.8mol CH3OH、1.5 mol H2O,则此时反应所处的状态为____________________________________(填“向正反应方向进行中”、“向逆反应方向进行中心”或“平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A.该反应的平衡常数表达式为K=![]()
B.平衡时c(CH3OH)=0.04 mol·L-1
C.该时刻正、逆反应速率的大小:v正<v逆
D.若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。

下列说法不正确的是_____________ (填字母序号)。
a. pH=8时,溶液中含碳元素的微粒主要是HCO3-
b. A点,溶液中H2CO3和HCO3-浓度相同
c. 当c(HCO3-)=c(CO32-)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是_____________。
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH-可以吸收烟道气中的CO2,同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:_____________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程产物中有CO2和_____________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_____________。
②上述方式使处理后海水pH升高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+ ![]() O2(g) =CO2(g)+2H2O(g)ΔH=-a kJ/mol,则a___238.6(填“>”、“<”或“=”)。
O2(g) =CO2(g)+2H2O(g)ΔH=-a kJ/mol,则a___238.6(填“>”、“<”或“=”)。
(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过分析,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______、________。
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
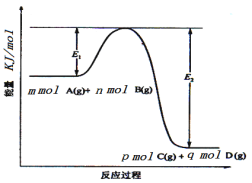
该反应ΔH=____kJ/mol(用含E1、E2式子表示);在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g) K,C(s)+CO2(g)
H2 (g) +CO2 (g) K,C(s)+CO2(g)![]() 2CO(g) K1,C(s) +H2O(g)
2CO(g) K1,C(s) +H2O(g)![]() CO(g) +H2(g) K2 ,则K、K1、K2之间的关系是 ___________。
CO(g) +H2(g) K2 ,则K、K1、K2之间的关系是 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()
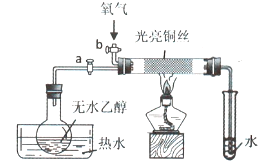
A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com