
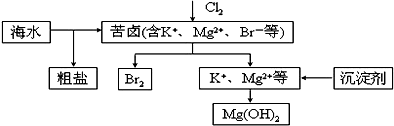
 氯气在实验室和生产中都有重要的应用.
氯气在实验室和生产中都有重要的应用.分析 (1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气;氯气和水反应生成盐酸和次氯酸,氯水、氯化氢二者都可与硝酸银反应生成白色沉淀;
(2)溶液中存在平衡Cl2+H2O?HCl+HClO,只有氯气有颜色,为黄绿色,氯水中,氯气大部分以分子形式存在,氯气能氧化氯化亚铁,碳酸氢根离子能与氯水中的氢离子发生反应生成水和二氧化碳;
(3)氯气具有强氧化性,能和溴离子发生置换反应生成溴,二氧化硫与溴发生氧化还原反应生成硫酸和氢溴酸.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气和水反应:Cl2+H20?H++Cl-+HClO,生成的氯化氢在水中电离出氯离子,能够与硝酸银溶液反应生成氯化银白色沉淀,所以甲同学的设计不能证明HCl的存在,
故答案为;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+H20?H++Cl-+HClO;
(2)溶液中存在平衡Cl2+H2O?HCl+HClO,
①只有氯气有颜色,为黄绿色,氯水呈浅黄绿色是由于含有氯气,故①正确;
②向FeCl2溶液中滴加氯水,溶液变成棕黄色,可发生反应2FeCl2+Cl2=2FeCl3,不能证明含有HClO,故②错误;
③向氯水中加入NaHCO3粉末,有气泡产生,是因为,碳酸氢根离子与氯水中的氢离子发生反应生成水和二氧化碳,故③正确;
故答案为:②;
(3)氯气具有强氧化性,能和溴离子发生置换反应生成溴,离子方程式为:Cl2+2Br-=Br2+2Cl-,SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸,二氧化硫被氧化为硫酸,反应为:Br2+2H20+SO2═4H++2Br-+SO42-,
故答案为:Cl2+2Br-═2Cl-+Br2;Br2+2H20+SO2═4H++2Br-+SO42-.
点评 本题考查了氯气的制备以及化学性质及其应用,题目难度中等,注意掌握氯及其化合物的性质,充分考查了学生对所学知识的掌握情况,试题有利于培养学生的分析、理解能力灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应体系中Au2O是氧化剂 | |
| B. | Na2S4O6是还原产物 | |
| C. | 该反应体系中起还原作用的元素是Au2O中+1价的Au | |
| D. | 该反应体系中每转移2mol电子则消耗1molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,能使品红溶液和酸性KMnO4溶液褪色且常作食品的漂白剂 | |
| B. | 活性炭、H2O2、O3等都有漂白性 | |
| C. | 干燥的氯气和氯水都有漂白性 | |
| D. | Na2O2也有漂白性,其漂白原理和SO2相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g | B. | 8.1g | C. | 5.4g | D. | 10.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
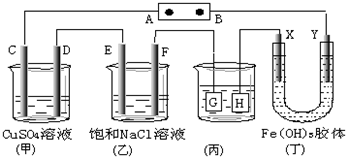
| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 氨水 | C. | AgNO3 溶液 | D. | NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com