
【题目】选择萃取剂将碘水中的碘萃取出来,这种萃取剂不可能是( )
A.苯 B.四氯化碳 C.酒精 D.汽油
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法,错误的是( )
A.元素周期表是元素按原子序数大小排列而成的
B.元素原子的电子层数等于其所在周期的周期序数
C.元素原子的最外层电子数等于其所在族的族序数
D.元素周期表中共有18列,16个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色澄清的溶液中,可能大量共存的离子组是( )
A. Cl-、SO32-、Fe2+、H+ B. NH4+、Al3+、NO3-、HCO3-
C. Na+、K+、OH-、AlO2- D. K+、Na+、SO42-、MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法曾广泛用于工业制纯碱(Na2CO3),是我国科学家为人类做出的重大贡献.现有25℃时,浓度为0.10mol/LNa2CO3溶液.请回答:
(1)该溶液中c(H+) c(OH﹣) (填“>”、“=”或“<”).
(2)用离子方程式解释(1)的原因: .
(3)下列说法正确的是(填字母) .
a.Na2CO3在水中完全电离
b.c(CO32﹣)+c(HCO3﹣)+c(H2CO3)=0.1mol/L
c.c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
(4)用石墨作电极电解Na2CO3水溶液时,阴极反应式是 .
(5)Na2CO3溶液中的电荷守恒关系式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
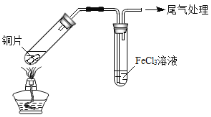
A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式: 。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20 mL 0.01 mol·L-1 KCl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1 HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
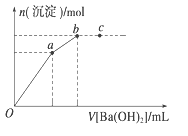
A.a点时溶液中所含主要溶质为(NH4)2SO4
B.a→b段发生反应的离子方程式是 SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C.b点为最大沉淀量,对应的纵坐标值为0.02
D.c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com